
Ваша теория и солидна и остроумна.
Впрочем, все теории стоят одна другой.
Воланд (М.А.Булгаков. Мастер и Маргарита)
Существует около сотни гипотез объясняющих природу старения, однако, научным сообществом из всего этого многообразия признано не более десятка концепций.
Большинство специалистов сходится во мнении, что старение является феноменом, включающим целый комплекс взаимозависимых процессов. Стабилизация одной составляющей комплекса, приведет лишь к сравнительно незначительному продвижению в направлении решения основной проблемы.
То есть, скорее всего, нет единой причины по которой мы стареем, (допустим, износ или самоубийство клеток), а есть целый ряд причин, суммарное действие которых и вызывает разрушительные последствия, которым придуман обобщенный термин - старение. Причем, такие разрушительные изменения происходят на клеточном, организменном, и молекулярном уровнях. Вероятно, многие конкурирующие теории старения правы по-своему, а каждая из них даёт лишь часть общей картины.
Несмотря на то, что полной ясности пока нет, (оптимистичные утверждения отдельных геронтологов в расчет не берутся), в последние десятилетия действительно достигнуто существенное продвижение в понимании ряда механизмов старения.
Есть серьёзные основания ожидать в ближайшие десятилетия перехода в стадию практического применения накопленных знаний. Можно ожидать достижения уровня науки и техники, необходимого для многократного увеличения продолжительности жизни, ближе к середине 21-го века.
Для этого требует совместная работа больших коллективов ученых, анализ систем организма связанных со старением, а также, возможно, моделирование таких систем при помощи высокопроизводительных компьютеров. Расшифровка генома человека, и расчет сворачиваемости белков, это небольшие шаги в направлении конечной цели.
Свободные радикалы
 ...Уж если медь, гранит, земля и море
...Уж если медь, гранит, земля и море
Не устоят, когда придет им срок,
Как может уцелеть, со смертью споря,
Краса твоя — беспомощный цветок?
В. Шекспир.
Кислород заставляет железо ржаветь, а масло - становиться прогорклым.
В процессе жизнедеятельности в нашем организме образуются агрессивные формы кислорода (свободные радикалы , они же оксиданты) и провоцируют процессы, сходные с ржавлением или гниением, это разложение буквально съедает нас изнутри.
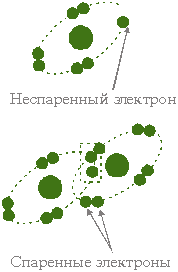
Агрессивные формы кислорода или оксиданты необходимы организму, они участвуют во многих физиологических процессах. Однако часто, число свободных радикалов возрастает сверх меры тогда, они же, разрушают всё, что попадает им "под руку": молекулы, клетки, кромсают ДНКвызывая клеточные мутации.
Свободные радикалы - это молекулы с неспаренным электроном.
Они весьма нестабильны и очень легко вступают в химические реакции. Такая нестабильная частица, сталкиваясь с другими молекулами, "крадет" у них электрон, что существенно изменяет структуру этих молекул.
Пострадавшие молекулы стремятся отнять электрон у других "полноценных" молекул, вследствие чего развивается разрушительная цепная реакция, губительно действующая на живую клетку. Цепные реакции с участием свободных радикалов могут являться причиной многих опасных заболеваний. Негативное действие свободных радикалов проявляется в ускорении старения организма, провоцировании воспалительных процессов в мышечных, соединительных и других тканях.
Установлено, что они отнимают у нас не один десяток лет жизни!
Научно доказано что Свободные радикалы, повинны в развитии таких болезней, как: рак, атеросклероз, инфаркт, инсульт, ишемия, атеросклероз, заболевания нервной и иммунной систем и заболевания кожи.
Подробнее об этих маленьких убийцах
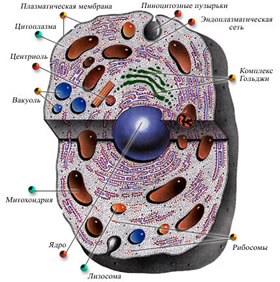
Оксиданты образуются в нашем теле четырьмя способами “Фабриками” свободных радикалов служат маленькие продолговатые тельца внутри клетки —митохондрии, ее энергетические станции.
Возникнув в клетке, радикалы повреждают ее внутренние структуры, а также оболочки самих митохондрий, что усиливает утечку.
В результате становится все больше и больше активных форм кислорода, и они разрушают клетку. Свободные радикалы, подобно "молекулярным террористам", "рыщут" по живым клеткам организма, повергая все в хаос.
Надо сказать, что природа заложила в организм собственные средства защиты от избытка свободных радикалов.
Система работает, но через нее все же постоянно проскальзывают отдельные радикалы, которые не успели вступить во взаимодействие с антиокислительными ферментами.
Когда уровень свободных радикалов возрастает (особенно при инфекционных заболеваниях и при длительном пребывании на солнце, во вредном производстве и т.п.), возрастает и потребность организма в дополнительных антиоксидантов , (они действуют как ловушки для свободных радикалов).
Например, курильщикам нужно втрое больше витамина C, чем некурящим, чтобы поддерживать такой же уровень антиоксидантов в крови.
Борьба со свободными радикалами идет несколькими путями: с помощью препаратов - "ловушек", нейтрализующих уже имеющиеся свободные радикалы, и средств, препятствующих образованию свободных радикалов.
Например, биофлавоноиды , открытые Альбертом Сент-Георги обладают способностью связывать свободные радикалы.
Еще в 1990 году Эймс и его коллеги из Калифорнийского университета в Беркли впервые объявили, что в тканях двухлетних крыс вдвое больше повреждений, вызванных свободными радикалами, чем в тканях двухмесячных крысят.
Группа Эймса открыла важнейшую зависимость между окислением, мутацией ДНК и возрастом, т.е. с возрастом мутации накапливаются, или как вариант, возраст (старение) это и есть клеточные мутации, которые со временем накапливаются.

Удалось объяснить и любопытное явление, которое достаточно давно обнаружили исследователи: изменения организма при естественном старении похожи на действие ионизирующей радиации, при воздействии такой радиации происходит разложение воды с образованием активных форм кислорода, которые начинают повреждать клетки.
Лимит Хейфлика
Как известно из начального курса биологии, клетки обладают способностью делиться. И какое то время они это охотно делают.
Однако, со временем, клетки утрачивают способность к самовоспроизведению. Это явление получило название "лимит Хейфлика" . Человеческая клетка в состоянии делиться всего 50—70 раз.
Этому были найдены причины внутри самих клеток. Когда молекула ДНК воспроизводит себе подобную, для нее это не обходится без потерь — кончик молекулы теломеруменьшается. Это происходит при каждом очередном делении, пока наконец он не истощается совсем и молекула ДНК уже не может выполнять свою функцию, а клетка соответственно не может больше делится.
Не смотря на то, что "лимит Хейфлика" это ограничитель не позволяющий жить бесконечно долго, есть мнение, что сей ресурс не вырабатывается за время жизни современного человека. Так Алексей Оловников (первый кто предположил о существовании теломер) говорит: действие теломер доказано, однако к старению сегодня, это не имеет прямого отношения. Каждый курильщик со временем умрет от рака - только не все доживают до момента, когда это произойдет, вероятно так и с теломерами.
Пока неизвестно какое место дальнейшие исследования отведут роли теломеров, в комплексе взаимозависимых процессов приводящих к старению. Учитывая что эта концепция получила широкую огласку, мы расскажем о ней подробнее.
Как было сказанно - клетки человека не могут бесконечно делитьсяч за исключением эмбр, половых, раковых.
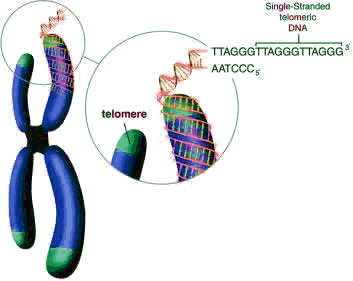
Клетки с очень короткими теломерами, часто дают сбои при делении, так как их "укороченные" хромосомы становятся нестабильными.
Хромосомы оказываются менее защищенными перед воздействиями различных повреждающих факторов, так как именно теломера, словно наконечник защищает их.
Фермент теломераза играет важную роль в синтезе теломера на конце молекулы ДНК.
В экспериментах ученые смогли изменить ход процесса старения у клеток путем введения в ДНК генов, отвечающих за образование фермента теломеразы.
Раковые клетки, могут делится бесконечно, в них включен ген теломеразы, т.е. злокачественная клетка становится похожей на половую или эмбриональную, только в этих клетках ген присутствует, и восстанавливает нормальную длину теломера.
Группа исследователей из «Geron Corporation» ввели в клетки ген фермента теломеразы.
Тоесть, начал синтезироваться фермент, удлиняющий теломеры, клетки приобрели способность делиться в 2 раза больше, т.е. продолжительность их жизни возросла.
Клетки человека обладают способностью делиться 50–60 раз. В опытах группы "Герон" после введения теломеразы клетка дает свыше 100 делений. Ракового перерождения клеток не происходит.
Как сообщалось в одном издании корпорации "Герон", исследователи, которые проводят лабораторные опыты с теломеразой, уже продемонстрировали, что можно изменить обычные клетки человека так, чтобы они делились и размножались бесконечно.
В январе 1998 года средства массовой информации во всем мире буквально взорвались сообщениями о том, что группе американских ученых удалось заставить нормальные клетки человека преодолеть "лимит Хейфлика".
Вместо того чтобы состариться и умереть, клетки продолжали делиться.
При этом превращения их в раковые клетки (то есть злокачественной трансформации) не происходило. По всем признакам клетки, были нормальными. В газетах немедленно появились статьи с заголовками вроде "Генетики уткнулись в бессмертие", "Лекарства от старения будут доступны, как аспирин", "Таблетки от старости становятся реальностью" и т.п.
На самом деле, ученые работающие под патронажем "Geron Corporation", с помощью генетических манипуляций заставили в нормальных клетках человека работать фермент теломеразу, активность которой до этого была нулевой.

Таким образом, теломераза и стала причиной спасения ЕДИНИЧНЫХ клеток от одряхления.
Разумеется, не стоит буквально рассматривать гены, кодирующие белковые субъединицы теломеразы, как "гены бессмертия".
К тому же, поддержание длины теломерной ДНК на определённом уровне зависит не только от взаимодействия с ней теломеразы и теломерсвязывающих белков, но и от других, пока неизвестных факторов, регулирующих образование самих компонентов теломер-образующего комплекса.
Но тот факт, что введение в раковые клетки HeLa препаратов, блокирующих РНК-компонент теломеразы, приводит к укорочению теломер и последующей гибели клеток, вселяет надежду на появление новых средств борьбы с раком.
Апоптоз и старение

Апоптоз - это биологический ассенизатор. Он включает гибель (саморазрушение) неправильно развивающейся, потенциально опасной или просто ненужной для окружающих тканей клетки, апоптоз предохраняет организм.
К примеру, на апоптозе основана и защита от раковых заболеваний - соседи раковой клетки убивают себя, образуя “мертвую зону”, и только сбой в программе массового суицида приводит к заболеванию раком.
Мировая наука освятила апоптоз отдельной клетки. За открытие генов, задача которых - кодировать белки, провоцирующие самоубийство клеток в 2002 году была присуждена Нобелевская премия по физиологии. Когда возникает подозрение, что что-то не так, поступает приказ “уйти из жизни”, он передается через цепочку белков, последний сообщает клетке приказ исполнить, и она начинает распадаться.
Польза и вред апоптоза
Если нет приказа умереть, то клетки могут жить очень долго, даже если на самом деле начнут приносить вред организм у.Конвейер приказов “казнить, нельзя помиловать” работает без адвоката и суда присяжных, и вместе с действительно “вредными” уничтожаются и просто "подозреваемые", на основании законов которые действуют в организме.
Если апоптоз выходит из-под контроля, то гибель клеток становится патологической. Усиленный, неконтролируемый апоптоз вызывает массированную гибель клеток.
Одна клетка, решая покончить с собой, может посылать смертоносный сигнал своим соседям, в результате погибает не она одна, а целый клеточной пласт.
Давно было замечено, что при облучении радиацией большая часть клеток погибает не от повреждений, а так сказать по “своей воле”. Именно явление коллективного самоубийства клеток отвечает главным образом за последствия инфаркта и инсульта.
Апоптоз и клеточное старение

Группа канадских биологов нейтрализовала два гена отвечающих за апоптоз у червей, в организме которых всего тысяча клеток. Эти черви стали жить в шесть раз дольше. Строение человека гораздо сложнее, апоптоз выполняет необходимую организму функцию, удаляет поврежденные клетки и клетки с нарушенной функцией, поэтому если просто отключить апоптоз, это сократит жизнь человека.
Хотя апоптоз безусловно полезен для молодого организма, он может приводить к неблагоприятным для здоровья явлениям в более позднем возрасте, способствуя старению организма.
С возрастом накапливаются повреждения в клетках (отдельная статья сайта), из-за этого растет и апоптическая клеточная убыль.
Некоторые старые клетки утратившие способность к делению, становятся резистентными (не чувствительными) к апоптозу, такие старые клетки накапливаются, достигается некий пороговый уровень, когда утрачивается прежнее здоровье тканей.
Очевидно что, многие аспекты рассмотренной проблемы требуют своего уточнения, что, безусловно, необходимо для выработки рациональной стратегии вмешательства в процесс.
Гипотеза о самоубийстве организма

Академиком Скулачевым В.П. выдвинуто любопытное предположение, о существовании некой генетической программы самоуничтожения, которая постепенно и разрушает организм.
Уже доказано, что по крайней мере для некоторых живых существ, смерть есть результат включения программы самоубийства, очень схожей с апоптозом по принципу реализации.
Вопрос лишь в том, присуща ли такая программа для человека. Хотя, возможно, убрав эту программу, мы запустим другую.
Сегодня многие специалисты соглашаются с тем, что старение и умирание давшего потомство индивида целесообразно с точки зрения эволюции. Старение, способствует ускорению совершенствования биологических видов, а также повышает выживаемость вида в целом. Но человечество, уже давно не уповает на естественный темп эволюции.
Гены старения
Если бы существовали гены целиком ответственные только за старение, и старение определялось (в большой степени) только ими, то в перспективе стала бы возможной коррекция генома и рождение (в результате искусственного оплодотворения) не стареющихдетей, при этом их дети тоже не старели бы. В недалеком будущем станет возможно изменять гены и уже живущего человека, с помощью нанотехнологий
Определяется ли генами различие продолжительности жизни, это ключевой вопрос. Казалось бы, однозначно положительно решает его различие в продолжительности жизни животных земли, которое варьируются до 1-го миллиона раз, и от 10 до 50 раз внутри групп с одинаковым уровнем организации. При этом нет жестких правил, вроде - большие животные живут больше маленьких, да и внутри одного вида, например грызуны или птицы встречается очень большая вариабельность. Некоторые виды черепах живут в около 300-т лет, обыкновенная щука может прожить 250-т.
Хотя нет убедительных доказательств, свидетельствующих о влиянии наследственности на продолжительность жизни у человека, в пользу того, что такая зависимость существует, говорит ряд статистическихисследований.
Недавно, нокаутировав ген простейшего червя, исследователи добились увеличения продолжительности его жизни в 6-ть раз. Эти черви, имеют длину менее одного миллиметра, состоят всего из тысячи клеток. Ни черви, ни мухи-дрозофилы (на которых тоже проводили подобные эксперименты) на старости лет не страдают от диабета, рака или болезни Альцгеймера, у них вообще нет костей. В отличие от человека это очень простые организмы. Пока таким способом удалось влиять лишь на старение отдельных примитивных организмов.
Старение человека обусловлено не одним, а многими сложными процессами, протекающими в организме. Поэтому найти один-единственный управляющий ген – например, ген старения или ген смерти от которого все зависит, вряд ли удастся, скорее это будет несколько генов.
Возможно, в процессе старения принимают участие не два-три, а все (или почти все) существующие гены человека. И каждый ген по-своему определяет количество лет, отпущенных организму. При этом искать самый главный, ответственный за старение ген (или несколько таких генов) все равно что искать в муравейнике того главного муравья который раздает управляющие приказы своим сородичам :)
Есть мнение, что генетические факторы старения все же существуют, и процесс старения регулируется наследственностью для обычного человека в диапазоне примерно 25%.
Гены, определяющие МЕЖВИДОВЫЕ различия продолжительности жизни действительно гены долголетия. Пока невозможно какой-либо ген определенно отнести к этой категории, но предполагается что эти гены должны регулировать течение множества процессов развития и дегенерации.
Триада механизмов

Все, что может испортится – портится.
Все, что испортится не может – портится тоже.
Эффекты Чихзолма
С возрастом, разрушительные изменения происходят на клеточном, организменном, и молекулярном уровнях. Вероятно, многие конкурирующие теории старения правы по-своему, а каждая из них даёт лишь часть общей картины.
Механизмы клеточного старения
Физиологические механизмы старения
Молекулярные механизмы старения
Механизмы клеточного старения
Клеточное, старение определяется тремя процессами: Невозможностью деления, снижением "работоспособности" клеток, которым не положено делиться (большинство нервных и мышечных клеток), либо снижение "работоспособности" клеток, которые утратили способность делится, а также старение клеток в результате различных генетических мутации.
Ограниченное количество делений
Клетки человеческого организма могут делится ограниченное число раз. Это явление получило название лимит Хейфлика.
После 50-70 делений клетки переходят в неделимое состояние. Иногда при этом они становятся нечувствительными к апоптическим сигналам>>> которые заставляют старую ненужную клетку самоликвидироваться. Такие старые клетки накапливаются, достигается некий пороговый уровень, когда утрачивается прежнее здоровье тканей.
Накопление внутриклеточного мусора

Существует много причин, из-за которых клетки расщепляют большие молекулы и структуры на составные компоненты, используя для этого много различных способов.
Порой такие полученные соединения имеют настолько необычную структуру, что с ними не справляется ни один из само очищающих механизмов клетки. Подобные изменения весьма редки, но с течением времени они аккумулируются. Это не имеет существенного значения, если клетки продолжают регулярно делиться, поскольку деление понижает концентрацию шлаков, однако неделящиеся клетки постепенно наполняются шлаками различного типа в различных типах клеток. Таким образом, биологический мусор мешает нормальному функционированию клеток.
Генетические мутации
Со временем в результате различных повреждающих факторов в генах накапливается большое количество повреждений или мутаций. Накопление с возрастом таких мутаций в различных органах и тканях во многом и определяет развитие возрастной патологии, включая рак. Рак способен убить нас, даже если в одной клетке произойдут соответствующие мутации, в то время как любые потери функциональности в генах, не имеющих никакого отношения к раку, относительно безвредны, пока они не затрагивают множество клеток данной ткани. Повреждения и мутации ДНК могут служить причиной двух проблем: клетки либо "кончать жизнь самоубийством", либо прекращают делиться в качестве ответной реакции на повреждение ДНК, (предотвращая тем самым развитие рака).
Физиологические механизмы старения
Даже если бы отдельные клетки организма не старели и делится могли до бесконечности (например, как раковые), это не означало бы что и сам организм оставался бы молодым.
Каждый орган и любая структура человека, состоят из многообразия разных клеток. Если здоровы все клетки органа, это еще не значит что сам орган здоров, т.к. все зависит от того какие именно клетки, в каком месте и в какой именно взаимосвязи с другими находятся.
С возрастом в организме проявляется ряд изменений физиологического характера, вот некоторые из них:

Снижение веса мозга, и доли воды в нем, значительная утрата количества нейронов и изменение сосудистой циркуляции. Уже к 20 годам половина функционирующей ткани тимуса замещается жировой тканью. К 50-60 годам инволюция тимуса завершается в результате истощается иммунная система. Происходит снижение чувствительности гипоталамуса к гомеостатическим сигналам (элевационная теория Дильмана) это является причиной гормональной разбалансировки.
При всем многообразии взаимозависимых изменений, пока не всегда можно однозначно констатировать что является причиной, а что следствием (в результате появляется множество гипотез).
Так уменьшение уровня содержания некого гормона в крови может быть причиной процессов ведущих к старению, но также, возможно, это лишь побочное действие других дегенеративных процессов (т.е. следствие), либо, даже, защитная реакция организма на некие негативные изменения. Соответственно если искусственно поднимать уровень такого гормона, в первом случае продолжительность жизни увеличится, во втором останется без изменений, а в третьем уменьшится.
За последние десятилетия были подробно изучены, несколько физиологических механизмов старения, и уже существует ряд средств, для рационального вмешательства в процессы поддержания внутреннего равновесия организма.
Молекулярные механизмы старения
Ухудшение функционирования в результате трансформации молекул внутри клеток это старение на молекулярном уровне.
Одним из основных факторов, вызывающих молекулярные повреждения в живых клетках являются свободные радикалы>>>
Другой существенной причиной такого старения является возникновение сшивок молекул в клетках. Под воздействием глюкозы белковые молекулы сцепляются или склеиваются друг с другом (перекрёстное связывание) и теряют способность к выполнению своих функций. Было доказано что происходит увеличение таких связей с возрастом.
Негативный эффект при этом происходит не только от модификации белков, но и от происходящих вследствие этого повреждений свободными радикалами, а также из–за прямого повреждения ДНК, что приводит к мутациям которые также накапливаются. В настоящее время изучают подходы к предупреждению влияния гликозилирования на белки, с помощью фармакологических средств (группа антидиабетические бигуаниды). Меры против сшивок или сцепления молекул: низкокалорийное питание, ведущее к снижению сахара в крови; использование сахарозаменителей.

Большинство молекул, находящихся в водных растворах, со временем изменяются – в основном в результате взаимодействия с другими молекулами и атомами (тепловое движение, химические реакции, альфа-радиация) и под действием электромагнитных излучений (ультрафиолет, гамма-радиация). Молекулы могут распадаться на атомы, превращаться в другие молекулы, претерпевать структурные изменения. Последнее подразумевает, что в функциональном отношении молекула остается той же самой, при этом, однако, эффективность выполнения функции может меняться.
Это, в свою очередь, ведет к постепенному разрушению структуры и ухудшению функционирования клетки: нарушается целостность и проницаемость мембран, падает ферментативная активность, клетка засоряется продуктами обмена, нарушается синтез белков и регуляция клеточных процессов. Причем эти процессы характеризуются положительной обратной связью – неправильное или ухудшенное функционирование молекул приводит к увеличению потока повреждающих воздействий.
Существует ли секрет молодости?
Интервью дает Олег Глотов, 30 лет. Кандидат биологических наук, старший научный сотрудник лаборатории пренатальной диагностики наследственных заболеваний человека НИИ акушерства и гинекологии им. Д.О. Отта СЗО РАМН (Санкт-Петербург).
— Расскажите, пожалуйста: какие сегодня существуют теории старения?
— Сейчас достаточно много теорий старения. Одну в свое время предложил Алексей Оловников — называется теломерная теория. Она основывалась на том, что определенные участки хромосом человека — теломеры — укорачиваются с течением жизни. Но после открытия стволовых клеток стало понятно, что причина старения не в этом. Действительно, теломеры есть и они укорачиваются, но это не связано с процессом старения.
Другая теория — свободно-радикальная. Заключается она в том, что свободные радикалы — активные формы молекулы кислорода — способны повреждать клетки. С возрастом происходит всё больше и больше этих повреждений, они накапливаются, клетка стареет, и организм вместе ней.
Есть митохондриальная теория. Основана она на том, что в геноме человека кроме геномной ДНК — той, которая содержится в ядре клетки, — есть еще так называемся митохондриальная ДНК. Она не содержится в ядре, а находится в клетке в свободной форме. Митохондрии отвечают за производство энергии. Там происходит очень много тех же свободно-радикальных реакций, которые способствуют, в том числе, повреждению клетки и ее преждевременному старению. И считается, что с возрастом мутаций в митохондриях накапливается всё больше, потому что они бесконечно делятся (или в результате деления), и в конечном итоге накопление этих мутаций является критическим для клетки, клетка умирает, и вместе с ней стареет организм.
Гипотеза, на основании которой была написана моя диссертация,— гипотеза так называемого слабого звена. Если в двух словах — это связано с генной предрасположенностью. Скажем, у человека выявлен определенный генетический маркер, который предрасполагает к сердечно-сосудистой патологии. Если человек будет вести неподходящий образ жизни, то эта патология у него разовьется раньше. А если он будет регулярно осматриваться и т. д., он сможет немножко больше «протянуть» при определенном генотипе.
— В 2007 году вы получили премию Геронтологического общества РАН за лучшую работу по геронтологии среди молодых ученых. Что это была за работа?
— Премию вручили мне и моей коллеге из Уфы. Обе работы были по генетике предрасположенности, мы изучали генетические маркеры в разных возрастных группах. И, в общем-то, пришли практически к одинаковому мнению, хотя гены были разные. Мы пришли к выводу: теория слабого звена действительно работает.
— А в чём практическая польза этого исследования?
— В том, что человек, зная особенности своего генома, может жить в согласии со своими генами. Он не кладет эти знания куда-то на полочку, а читает свой геном, как книжку. Допустим, человеку 40 лет. Он смотрит: генетической предрасположенности к сердечно-сосудистой патологии нет. Значит, в 40 лет он может не снижать физические нагрузки, проверяться не чаще, чем обычно. А другой человек читает: мне 40 лет, у меня риск инфаркта,— ему нужно призадуматься о своем здоровье, сделать ЭКГ, проверить липидный спектр, гомоцистеин, еще какие-то маркеры, которые могут быть признаками приближающегося инфаркта.
— А такое исследование генома легко сегодня сделать в России?
— Сейчас есть много организаций, которые предлагают такие исследования. Исследование на самое большое количество генетических маркеров делают в нашем институте в Петербурге.
— А дорого это стоит?
— От 300 рублей до 30 тысяч. Зависит от того, сколько маркеров вы изучаете. Грубо говоря, один маркер — 300 рублей, 100 маркеров — 30 тысяч. Но чем больше маркеров изучаешь, тем больше понимаешь взаимоотношение этих маркеров. Человека обследуют на различные маркеры — биохимический, генетический, еще что-то посмотрят, ЭКГ сделают — и вот только в совокупности, когда грамотный врач обрабатывает информацию, он может точно сказать, что человеку грозит в плане старения. Но таких специалистов, к сожалению, у нас по стране очень мало. Есть отдельные врачи, которые понимают в «anti-ageing»,— в Петербурге, в Москве... а в других городах я даже и не слышал, чтобы такие специалисты были.
— Почему одни люди стареют раньше, другие позже? В чем секрет молодости?
— Знаете, пытались найти «ген преждевременного старения», но так и не нашли. Наверное, его и не должно быть — так, чтобы сказать однозначно: вот этот человек постареет раньше, а этот позже. Можно только сказать, что вот у этого человека риск заболевания может привести к тому-то, тогда он постареет раньше другого человека.
Тут еще, видите, много всего завязано на грамотности исследования. Все эти исследования должны в первую очередь проходить на близнецах. Близнецы — это уникальная модель, помогающая отделить наследственные компоненты от ненаследственных. Но геном человека расшифровали совсем недавно, и подобные исследования — чтобы в течение всей жизни человека провести и посмотреть — появятся очень нескоро. Но вот у меня есть брат-близнец, тоже генетик,— мы друг на друге наблюдаем всё это…
— А вы на себе ставите эксперименты?!
— Вся жизнь — эксперимент (смеется).
— Можете объяснить популярно, за что дали Нобелевскую премию по медицине в этом году?
— Эти ребята выделили фермент теломеразы на основании предсказаний Оловникова и показали, что теломераза работает. Достраивают эти укороченные части хромосом, и хромосома начинает заново функционировать. В ней содержатся определенные гены, которые репрессируют образование опухолей. И если рассмотреть такой вариант: хромосома была нормальная, полноразмерные теломеры — опухоль не развивалась. Потом теломеры укорачиваются с каждым циклом — и если фермент теломеразы не работает, то начинают активизироваться (не блокироваться) гены, которые допускают рост опухолей.
Кстати, мне тут коллеги объясняли, почему премию не дали Оловникову,— потому что ее дают за практические результаты, но не за теории…
— Британский геронтолог Обри ди Грей считает, что через 20 лет, при достаточном финансировании исследований, ученые смогут продлить человеку жизнь до 1000 лет. Как вы к этому относитесь?
— Этот бред я тоже слышал. У человека биологический возраст определяется 120–125 годами. Кто-то будет выбиваться из этой нормы, но в принципе заложен такой возраст, и сделать его больше — это просто нереально.
— Получается, есть ученые, которые считают, что старение — это программа, которую можно отменить, и бессмертие возможно, но вы считаете, что это невозможно, да?
— Да. Во всяком случае, в таком крупном масштабе — в 10 раз… Понимаете, чем проще организм, тем проще продлить ему жизнь. У нематод получается продлить жизнь в 10 раз. У мыши — уже только в несколько раз, у еще более сложных организмов — на 10–30% максимум. Если брать средний возраст человека — 70 лет, то вот 30% к этим 70 годам можно добавить. Что мы получаем? Мы получаем даже меньше 120 лет…
— А увеличить до 120, как вы думаете, когда удастся?
— Тут цель — увеличить даже не общую продолжительность жизни, а, главное, качество жизни, замедлить процесс старения. Лучше 100 лет прожить качественно, чем прожить 120, а из них последние 30 лет непонятно как. То есть омоложение – более ценно, чем само по себе продление жизни.
А когда — ну, я думаю, лет через 50 уже вплотную подойдут к 120 годам.
1) http://starenie.ru/prichini/
2) http://starenie.ru/prichini/radikali.php
3) http://starenie.ru/prichini/limitx.php
4) http://starenie.ru/prichini/apoptoz.php
5) http://starenie.ru/prichini/geni.php
6) http://starenie.ru/prichini/triada.php
7) http://starenie.ru/prichini/secret_molodost.php















Комментарии (5)