
Американцы довольны жизнью, но не хотят жить слишком долго и не считают, что это хорошо для общества. Даже такую жизнь нет желания продлевать до 120.
Даже такую жизнь нет желания продлевать до 120
В не столь отдаленном будущем человек сможет жить как минимум до 120 лет, но сами люди этого, как ни странно, не хотят. По крайней мере, американцы.
Американское общество стремительно стареет, доля пожилых людей увеличивается из-за снижения рождаемости и роста продолжительности жизни. В современном американском обществе — примерно 41 млн человек в возрасте 65 лет и старше. Это 13% населения по сравнению с 4%, что составляли пожилые люди в 1900 году. Доля людей за 65 растет самыми высокими темпами по сравнению с остальными возрастными группами.
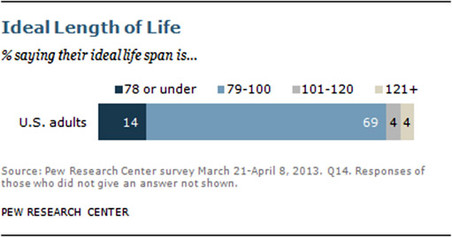
% людей, сказавших, что они хотят прожить78 или меньше, 79-100, 101-120, 121 и больше
Как относятся люди к долгожительству и сколько они хотят прожить — этому посвященоисследование, проведенное американской социологической компанией Pew Research Center среди американцев. Социологи проводили телефонный опрос более 2000 респондентов в 50 штатах США в марте – апреле 2013 года. Людей спрашивали о качестве их жизни, уровне медицины и перспективах на будущее, в частности о перспективах радикального продления жизни для них самих и для общества.
56% опрошенных американцев в возрасте от 18 и старше сказали, что они не хотели бы жить до 120 лет или больше. 69% американцев хотели бы прожить от 79 до 100 лет.
14% не пожелали жить дольше 78 лет, всего 4% захотели жить от 100 до 120 и еще 4% — больше 120 лет. Эти цифры очень незначительно колеблются в зависимости от возраста респондентов. Так, среди молодых людей до 29 лет выше доля тех, кто считает достаточным прожить до 78 лет (19%), а среди пожилых эта доля снижается до 6%. Среднюю желательную продолжительность жизни молодые люди определили в 85 лет.
В среднем же по выборке разных возрастов желательная продолжительность жизни составила 90 лет, это на 11 лет больше, чем ожидаемая продолжительность жизни в США сегодня. Это личный выбор людей для себя. Интересно, что при этом 68% опрошенных уверены, что остальные люди хотят иметь возможность продлить жизнь до 120 лет.
Большинство американцев (90%) не видят ничего плохого в том, что в обществе увеличивается доля пожилых людей, только 10% не одобряют эту тенденцию.
Американцы довольны своей жизнью и смотрят на будущее оптимистично. Об удовлетворенности своей сегодняшней жизнью сказали 81% опрошенных, из них 56% уверены, что через 10 лет их жизнь станет еще лучше. Самыми большими оптимистами, конечно, оказались молодые люди, но даже из тех, кому за 65, две трети уверены, что их жизнь в следующие 10 лет улучшится или не изменится. 57% ответили, что их не беспокоят финансовые и прочие проблемы в их жизни.
Люди верят в прогресс медицины в последующие десятилетия.
Примерно 70% опрошенных уверены, что в 2050 году будет побежден рак, а протезы конечностей будут более совершенны, чем настоящие руки-ноги.
Хотя их оценки сегодняшней медицины не столь однозначны. 41% заявили, что современная медицина больше вызывает проблем, чем решает, и только 24% сказали, что они безусловно доверяют эффективности и безопасности новых методов лечения.
В возможность радикального продления жизни люди тоже верят. На вопрос, будет ли человек жить до 120 лет к 2050 году, 73% ответили утвердительно. Две трети (63%) оценили достижения медицины по продлению жизни как положительные явления для человека, и только 32% считают, что неправильно медицине вмешиваться в естественное старение.
Но эта перспектива для общества оценивается людьми неоднозначно.
51% респондентов сказали, что продление жизни будет плохо для общества, и только 41% решили, что это будет хорошо.
На вопрос, будет ли это полезно конкретно для экономики, положительно ответили 44%.
Интересно, что в отношении к продлению жизни выявились и этнические различия.
Афроамериканцы и испаноговорящие американцы больше, чем белые американцы, склонны расценивать это положительно. Они также желали бы прожить дольше, чем белые американцы (в среднем 94 года).
Среди женщин и мужчин различий не обнаружилось.
Есть также различия во взглядах на продолжительность жизни среди разных религиозных групп американского общества. Примечательно, что среди белых католиков и белых протестантов наименьшая доля тех, кто расценивает перспективу продления жизни положительно для общества: 31 и 34% соответственно (в среднем по выборке — 41%).
79% считают, что каждый человек, если он этого хочет, должен иметь возможность воспользоваться услугами медицины по продлению жизни. Но в реальности, думают две трети, эти услуги будут доступны только богатым.
«Они были вечно молодыми»
О разработках лекарств для продления жизни в интервью «Газете.Ru» рассказал профессор Рис, продливший жизнь нематодам в десять раз
Роберт Шмуклер Рис, профессор Университета медицинских наук Арканзаса (Литл-Рок, США)

Как ученым удается продлить жизнь живым организмам в 10 раз, какие лекарства для замедления старения будут использоваться в будущем, «Газете.Ru» рассказывает один из самых известных ученых в мире в области старения и продолжительности жизни профессор Университета медицинских наук Арканзаса (Литтл-Рок, США) Роберт Шмуклер Рис
— Расскажите про ваши эксперименты с продлением жизни нематоды. Какими генетическими манипуляциями удалось этого добиться?
— Мы обратили внимание на исследования двух лабораторий, которые работали с нематодами. И поняли, что они пропустили возможность серьезного увеличения продолжительности жизни. В этих лабораториях изучали мутации гена, который необходим для репродукции. Но если у червя только одна копия гена плохая, а другая хорошая, то такие гетерозиготные черви могут иметь потомство. Среди их потомства четверть особей будет нести две копии плохих генов, это первое поколение гомозигот. Именно этим первым поколением и занимались те две лаборатории, но эти черви жили всего лишь в два раза дольше. При этом они, несмотря на дефектные гены, все равно могли откладывать яйца. Мы предположили, что от своих матерей через цитоплазму яйца они получили РНК или сам белок, который и позволил им иметь потомство.
Так были получены нематоды второго поколения гомозигот, и вот они-то уже совсем не могли размножаться. Исследователи не посмотрели, сколько проживут эти черви, поскольку подумали, что те никогда не смогут развиться в полноценную особь. Но слово «никогда» определяется вашим терпением. У нас с терпением было все в порядке, мы стали наблюдать за этими червями и обнаружили, что у них замедленное развитие: до взрослого состояния они развиваются не за два дня, как обычно, а от 8 до 16 дней. Нематоды — холоднокровные, и на скорость их развития влияет температура. Обычно развитие происходит быстрее при температуре 25 градусов. Но у этих червей при 25 градусах развития вообще не было, а развивались они только при температуре от 16 до 20 градусов. Скорее всего, это происходило потому, что репликация ДНК происходила медленно из-за отсутствия гена и не поспевала за другими молекулярными механизмами. Нормальное развитие происходит, когда все системы работают синхронно.
Мы решили посмотреть на здоровье нематод второго поколения.
И выяснилось, что они всегда выглядели на десятую часть своего возраста, были вечно молодыми. Кроме того, оказалось, что они очень хорошо переживали оксидативный и химический стресс. Что до продолжительности жизни, то эти нематоды прожили в десять раз больше обычных, а именно 190 дней.
— Какого гена они были лишены?
— У нематод этот ген получил название Age-1. У млекопитающих аналог этого гена — ген фосфаинозитол-3-киназы (PI3K).
— Распознали ли вы механизм действия этого гена на продолжительность жизни?
— Мы работаем над этим. Мы не знаем точно, но думаем, что в отсутствие этого гена выключаются многие сигнальные пути. Мы видим существенную разницу в транскрипционной активности у второго поколения по сравнению с первым. То есть у второго поколения синтезируется очень мало белков.
— Долгоживущие нематоды были обычного размера или мелкими?
— Сначала они были маленькими, так как очень медленно росли, но потом приобретали нормальные размеры.
— У млекопитающих часто увеличение продолжительности жизни сопровождается уменьшением размеров тела и снижением метаболизма. Это закономерность?
— Существует несколько примеров, в которых долгоживущие мыши не мельчают в размерах. Один пример — это мыши, у которых не работает ген PEPCK. Второй — мыши, у которых нет активности гена PI3K. Три года назад японские исследователи опубликовали работу, в которой они выключили ген PI1K в сердце мышей. На продолжительность жизни они не смотрели, но оценивали у мышей здоровье сердца. Животным предлагали тесты, как пациентам у кардиолога: тест на беговой дорожке и химический стресс-тест. Только размеры беговой дорожки были поменьше, чем для людей. Обычные мыши в 20-месячном возрасте плохо переносили такие тесты, а нокауты справлялись с ними гораздо лучше.
Во второй работе, которая вышла два месяца назад, ученые отобрали у мышей одну копию этого гена, но во всем теле. Сначала эти мыши были похожи на диабетиков, но после 20 месяцев вместо инсулинорезистентности у них появилась инсулиночувствительность. А продолжительность жизни в результате увеличилась на 17–18%.
— У нематоды и человека общие механизмы старения?
— Да, конечно.
Сигнальные пути, о которых нам известно для млекопитающих, в том числе для человека, сначала были открыты на простых модельных животных. Все сигнальные пути, играющие роль в старении, эволюционно консервативны.
— А лекарство от старения — это пока всего лишь идея или конкретные разработки?
— На сегодня показано, что существует несколько веществ, которые увеличивают продолжительность жизни. Это аспирин, продлевающий жизнь мышам на 8–12%, и рапамицин, продлевающий жизнь мышам на 14%.
— Чем объясняется эффект аспирина?
— У трети людей аспирин вызывает раздражение желудочно-кишечного тракта, но при этом он снижает частоту нескольких возраст-зависимых заболеваний — в первую очередь это инфаркты и инсульты.
— За счет того, что разжижает кровь?
— Проводились масштабные исследования, чтобы понять, что в конечном счете перевешивает — положительные эффекты аспирина или возможные отрицательные эффекты. В итоге оказалось, что положительные перевешивают. Помимо снижения риска сердечнососудистых заболеваний обнаружились другие позитивные эффекты аспирина.
Самый большой — снижение заболеваемости болезнью Альцгеймера (от 22% до 28%) и снижение инсулинорезистентности и заболеваемости диабетом II типа. Также снижается заболеваемость некоторых видов рака, характерных для позднего возраста.
Ученые всегда ищут более простого ответа — в соответствии с принципом бритвы Оккама. И в данном случае ответ состоит в том, что аспирин замедляет старение. Исследования на людях показали, что при приеме аспирина происходит снижение смертности от всех причин на 6–8%. А исследования на мышах показали, что мыши живут дольше. Изучив механизм действия аспирина на нематодах, мы поняли, что он блокирует работу инсулиноподобного сигнального пути и снижает уровень окислительного стресса. Мы продолжаем исследования, и у нас есть вдохновляющие результаты.
— А каковы перспективы вашего лекарства с генетическим механизмом действия?
— Наша цель — создать фармакологический препарат, который бы блокировал деятельность фосфаинозитол-3-киназы, но его нужно принимать только в зрелом возрасте.
Это шутка, но его можно было бы рекламировать как таблетку, продляющую жизнь, «в одном флаконе» с контрацептивом. Хотя он не полностью блокирует репродукцию, все зависит от режима приема.
Мы исследовали ингибитор PI3K и увидели, что он положительно влияет на здоровье и увеличивает чувствительность к инсулину у мышей.
Но — я хочу это подчеркнуть — преждевременно бежать в аптеку и покупать препарат. Я уверен, что в большой дозе он может быть смертелен!
Важен факт, который мы показали: вещество в небольшой дозе может повторять эффект генетического вмешательства. Это, собственно, то, чем занимаются фармкомпании: сначала вы изучаете генетический эффект, а потом ищете вещество, которое будет его повторять. Единственная проблема: фармкомпании не прослеживают эффект лекарства достаточно долго.
— Можете ли вы дать прогноз, когда появится ваш препарат?
— Мы проводим исследования в коллаборации с российской компанией «Квантум Фармасьютикалс». Я могу довольно точно предсказать, когда препарат будет испытан на моделях животных. У нас уже есть первое поколение веществ-кандидатов, которые приведут к появлению второго поколения еще лучших кандидатов, и на все это может уйти меньше года. А потом нужно будет начать стандартный процесс выведение лекарства на клинические исследования, и это займет гораздо больше времени. Сколько — я предсказать не берусь.
Человек стареет не как телега, а как лошадь
Секрету долгой жизни нас научат голый землекоп и летучая мышь: они размножаются всю жизнь и не болеют раком

Алексей Москалев, Институт биологии Коми НЦ УрО РАН
О том, что такое старение, о роли генов в продолжительности жизни «Газете.Ru» рассказал доктор биологических наук, руководитель лаборатории молекулярной радиобиологии и геронтологии Института биологии Коми НЦ УрО РАН Алексей Москалев.
— Сегодня существует множество теорий механизмов старения. Какая из них вам наиболее близка?
— Как известно, старение — это процесс постепенного угнетения основных функций организма (регенерационных, репродуктивных и др.), вследствие которого организм теряет способность поддерживать внутреннее постоянство, противостоять стрессам, болезням и травмам, что делает гибель неизбежной. Я считаю, что старение — одно из наиболее комплексных биологических явлений, и какая-либо одна теория к нему вряд ли применима. На разных уровнях (молекулярном, клеточном, системном) протекает множество разрушительных процессов, вызванных разными причинами, и, какая из причин будет главной в данной ткани у данного индивидуума, будет определять спектр возрастных болезней, скорость их протекания, различия продолжительности жизни и причины смерти.
Однако важную роль я отвожу снижению с возрастом продуктивности систем защиты от различных видов стресса, в частности, репарации повреждений ДНК и белков.
На организменном уровне нарушение регенерации связано с изменением уровней определенных белков — факторов роста и гормонов.
— Что сегодня известно о роли генов в продолжительности жизни?
— Анализ имеющихся у нас сведений позволяет обобщить роль генов продолжительности жизни следующим образом:
1. «Регуляторы» продолжительности жизни. Играют роль переключателей программы продолжительности жизни между режимом бурного роста и размножения (при ускоренном старении), с одной стороны, и режимом самоподдержания (и долгой жизни) — с другой. Например, когда условия жизни благоприятны, организм усиленно растет и оставляет потомство, но стареет быстрее, он как бы перебрасывает силы от стрессоустойчивости к более важным процессам. В условиях умеренного стресса (недостатка пищи, жары или холода) рост и оставление потомства невыгодны, организм должен «сконцентрироваться» на том, чтобы пережить неблагоприятный период, ресурсы перетекают на защиту от стресса, старение замедляется. Переключателями этих двух режимов жизнедеятельности служат гены, продукты которых отвечают за восприятие и передачу внешнесредовых сигналов, синтез, рецепцию и трансдукцию гормонов инсулинового пути, вторичных липофильных гормонов. Большая часть из них способствует росту и размножению, но подавляет стрессоустойчивость. Некоторые гормоноподобные пептиды, напротив, стимулируют устойчивость к стрессу (например, Klotho).
2. «Медиаторы» долголетия (различные киназы, деацетилазы белков, транскрипционные факторы). Под действием регуляторов они осуществляют переключение программ стрессоустойчивости в ответ на сигналы из окружающей среды (наличие пищи, гипоксию, условия температурного и светового режимов, облучение) или внутриклеточный окислительный стресс. Тканеспецифичным образом продукты этих генов регулируют активность различных эффекторных генов либо непосредственно активность или время жизни эффекторных белков. Кроме того, «медиаторы» взаимодействуют между собой, подавляя или стимулируя эффекты друг друга.
3. «Эффекторы» продолжительности жизни. Прежде всего, это гены стрессоустойчивости: гены белков теплового шока, антиоксидантной защиты, репарации белков и ДНК, компонентов протеасомы, белков автофагии, врожденного иммунитета, детоксификации ксенобиотиков, регуляторов метаболизма. В определенном смысле это гены антистарения, и их индукция в эксперименте, как правило, увеличивает продолжительность жизни модельных животных. Зачастую они действуют аддитивно, то есть под действием отдельных «медиаторов» активируются сразу несколько «эффекторов», что способствует увеличению продолжительности жизни в условиях умеренного стресса. Ряд «медиаторов», напротив, подавляют активность «эффекторов».
4. Гены жизнеспособности. Их еще называют гены «домашнего хозяйства» (housekeeping genes). Функционируют повсеместно, на всех стадиях жизненного цикла, и обеспечивают структуру клетки, биосинтез аминокислот, липидов и нуклеотидов, гликолиз, цикл трикарбоновых кислот и т. д. Их мутации либо летальны, либо ведут к патологиям. В условиях стресса некоторые из них могут временно репрессироваться под действием «медиаторов», что позволяет сэкономить ресурсы для функционирования «генов-эффекторов» и увеличить продолжительность жизни.
5. Гены, участвующие в функционировании митохондрий. Это компоненты электронотранспортной цепи, аппарата биосинтеза митохондриальных белков, рассопрягающие белки. Регулируют энергетический метаболизм, уровень свободных радикалов, а некоторые из них — апоптоз.
6. Гены — регуляторы репликативного старения и апоптоза (p53, p21, p16, pRB). Участвуют в предотвращении рака, регуляции клеточного цикла и гибели ненужных или вредных клеток в раннем онтогенезе и зрелости. Побочным действием в старости является прекращение деления старых клеток соединительной ткани или убыль постмитотических клеток (нервной и мышечной систем).
— В чем генетические отличия животных-долгожителей?
— В настоящее время наиболее изученным практически нестареющим млекопитающим является грызун голый землекоп, который в неволе живет более 30 лет.
Зверек практически не теряет репродуктивную способность с возрастом, не заболевает раком.
Его клетки сложно убить веществами-оксидантами. Они способны быстро утилизировать поврежденные белки и в десятки раз устойчивее клеток мыши к действию стрессоров (тяжелых металлов, перекиси водорода).
— Расскажите про ваши исследования ночницы Брандта. Чем она замечательна и какие генетические особенности у нее удалось обнаружить?
— В России водится не менее уникальный медленно стареющий зверек — летучая мышь ночница Брандта. На всемирном конгрессе геронтологов в Париже в 2009 году я присутствовал на докладе американца Стивена Остада, который в соавторстве с новосибирскими коллегами выяснил, что этот мелкий зверек (в среднем весит 7 г) способен в условиях дикой природы дожить до 41 года.
Зоологи из Кирова и Сыктывкара готовы были отловить несколько образцов этой летучей мыши, а гарвардский профессор Вадим Гладышев, уже расшифровавший к тому моменту геном голого землекопа, согласился взяться за геном ночницы. Говоря о загадке выдающегося долголетия ночницы Брандта, стоит еще раз указать на то, что это одно из мельчайших млекопитающих.
Как оказалось, в ее геноме имеются мутации, снижающие эффективность ростовых гормонов (гормона роста и инсулиноподобного фактора роста), ускоряющих рост и старение организма.
Кстати сказать, комбинация диеты и мутации, снижающей эффективность гормона роста, позволила другим исследователям, Миллеру и Бартке, продлить жизнь обычным мышам с 2 до 4 лет. В геноме летучих мышей обнаружилось еще как минимум три особенности, потенциально способные объяснить ее долголетие, однако проверка этих предположений — дело дальнейших исследований.
— Какая связь выявляется между заболеваемостью раком и продолжительностью жизни?
— Обычные мыши практически все умирают от рака. У человека смертность от рака с возрастом достигает 25%. Вместе с сердечно-сосудистыми патологиями рак является самым распространенным возрастзависимым заболеванием.
Млекопитающие-долгожители (голый землекоп, обыкновенный слепыш, вероятнее всего, и ночница Брандта) раком не болеют. Большая загадка, почему.
Обладая уникальной возможностью изучать обитающих у нас слепыша и ночницу, совместно с коллегами из Рочестерского университета в США мы подали на мегагрант правительства России, объясняя необходимость подобных уникальных исследований, но поддержку властей не получили, сейчас размышляем, как выполнить эту работу за рубежом.
— Многие исследования показывают, что увеличение продолжительности жизни некоторых животных сопровождается карликовостью. Каков механизм этой связи?
— Рост и деление клеток конкурируют за энергетические и пластические ресурсы со стрессоустойчивостью, клетке всегда приходится выбирать: либо расти, либо бороться с повреждениями.
Гормон роста и регулируемый им инсулиноподобный фактор роста запускают в клетках каскад реакций, ведущих к росту и делению клеток при одновременном отключении клеточных механизмов стрессоустойчивости. Снижение чувствительности к этим гормонам приводит к карликовости при деблокировании клеточных систем противодействия стрессам, в результате продолжительность жизни возрастает.
— Какой стресс ускоряет старение?
— К стрессам приводят существенные отклонения внешних и внутренних параметров жизни клеток от оптимальных (концентрации питательных веществ, рН, уровня кислорода, температуры). Оксидативный, генотоксический стресс, митохондриальный стресс, стресс эндоплазматической сети — разные виды сложных внутриклеточных процессов, приводящих к накоплению повреждений клеточных структур. Поврежденная клетка хуже справляется со своими задачами, не способна участвовать в физиологических функциях и регенерации тканей.
Геронтологи часто говорят о принципиальном различии старения «телеги» от старения «лошади». «Телега» накапливает поломки и перестает выполнять свою функцию. «Лошадь» активно противостоит внутренним поломкам на уровне каждой клетки до тех пор, пока не ломаются сами механизмы борьбы с поломками, которые и называются стрессоустойчивостью.
Механизмы ответа на повреждение ДНК, белков, липидов мембран, детоксификации токсинов с возрастом либо снижают свою эффективность, либо начинают работать неадекватно.
Поэтому настоящей причиной старения является не собственно накопление повреждений клеток, а утрата механизмов борьбы с повреждениями.
Искусственная индукция активности по крайней мере одного из генов стрессоустойчивости, GADD45, в нервной системе мух позволила нам продлить жизнь этим модельных животным на 70%.
Вы говорили о найденной ассоциации обоняния и продолжительности жизни. У каких животных это обнаружено? Как можно объяснить эту связь?
— Удивительно, но некоторые млекопитающие-долгожители, в частности голый землекоп, ночница Брандта и человек, имеют сниженную обонятельную чувствительность. Кроме того, модельные генетические эксперименты на червях, мухах, а сейчас и мышах показали, что мутации генов обонятельных рецепторов продлевают жизнь.
Причина, похоже, в тех же генах-регуляторах, которые в ответ на запах пищи активируют инсулиноподобный сигнальный путь роста и развития. Кстати, эксперименты на мухах показали, что если фактор низкокалорийной диеты, продлевающей жизнь, сочетать с запахом любимой их пищи (дрожжей), замедление старения практически исчезает.
— Что такое старение — этап развития? Болезнь? Можно ли его отменить или отодвинуть?
— Многие болезни характеризуются экспоненциальным ростом с увеличением возраста, что говорит об их непосредственной связи со старением. Это позволяет говорить о том, что старение является причиной большинства этих болезней (многие виды опухолей, сердечно-сосудистые болезни, ретинопатия, катаракта, диабет II типа и т. д.) и важным фактором риска других причин смерти (вирусные заболевания, несчастные случаи и т. д.). Некоторые авторы, в частности главный редактор журнала Aging Михаил Благосклонный, считают, что пора говорить о самом старении как о болезни, а возрастзависимые патологии являются его проявлениями или биомаркерами. Принятие этого подхода может изменить современную медицину.
Борясь с конкретными проявлениями (отдельными возрастзависимыми патологиями) единой болезни — старения, врачи достигают лишь кратковременных успехов. Подавляя причины старения, в частности возрастзависимое снижение активности генов стрессоустойчивости, возможно ожидать гораздо большего продления жизни и улучшения качества жизни.
— Вы руководите лабораторией в Институте биологии в Сыктывкаре и в то же время лабораторией старения и продолжительности жизни в МФТИ. Почему в МФТИ? Какие исследования там проводятся?
— МФТИ — один из ведущих научно-образовательных центров страны, в этом вузе как нигде велика концентрация талантливой молодежи, на высоком уровне финансируются биотехнологические разработки. Моя лаборатория в МФТИ существует всего лишь месяц, и в настоящее время идет грантовый поиск. Хотелось бы на базе МФТИ внедрять инновационные исследовательские подходы — комплексный анализ биомаркеров старения человека (сочетание анализа метаболома, транскриптома и протеома), выявление новых генов долголетия и лекарств-геропротекторов на уникальной модели — короткоживущей (живет всего 6–7 месяцев) рыбке нотобранхе.
— По вашему мнению, появятся ли в ближайшем будущем лекарственные средства, продлевающие жизнь или замедляющие старение человека?
— Принципиальных причин, делающих невыполнимой задачу замедления старения человека, нет.
Об этом говорят исследования на модельных животных, которым удалось продлить продолжительность жизни от примерно в два раза (мыши) до в 10 раз (нематоды). Данные успехи были достигнуты генетическими методами, но, поскольку эти гены кодируют белки, существует вероятность найти низкомолекулярные вещества, которые будут регулировать функцию этих белков и замедлять старение.
Мышата лечат детей от старости
Ученым удалось справиться с явлением преждевременного старения, выключив всего один фермент

Найден способ победить прогерию — преждевременное старение. Пока опыты проводятся только на мышах, но есть надежда, что детей, слишком быстро проживающих свою жизнь, можно исцелить, выключив всего один фермент. Исследования этой болезнь и методов борьбы с ней могут стать основой для решения проблемы нормального старения у людей.
Прогерия — это редкое заболевание, известное также как прогерический синдром Хатчисонам — Гилфорда, которое вызывается спорадической мутацией всего лишь одного гена. Спорадическими называют мутации, которые не передаются ребенку по наследству от родителей, а возникают при созревании половых клеток или при развитии эмбриона.
Прогерия — болезнь генетическая, но не наследственная.
формируется оболочка клеточного ядра. Преламин А, созданный по лекалам гена-мутанта, делает эту оболочку несовершенной, что приводит к изменению структуры ядра, нестабильности генома и нарушению экспрессии генов. Дети, больные прогерией, быстро лысеют, у них стареет кожа, становятся хрупкими кости.
В шесть лет они выглядят стариками, а примерно в тринадцать умирают от инсульта или инфаркта из-за сильного атеросклероза.
Этим, собственно, и объясняется спорадический характер мутации: больные детской прогерией просто не успевают дожить до репродуктивного возраста и передать дефект по наследству.
Группа шведских биологов из Гётеборга под руководством профессора Мартина Бергё после многолетних исследований нашла способ если не починить мутантный белок, то, по крайней мере, обезоружить его, лишить способности состаривать организм. О своем методе, проверенном на мышах, исследователи рассказали в статье, опубликованной в последнем номере журнала Science. Они обнаружили, что основные неприятности с мутантным белком начинают происходить после того, как фермент, называемый ICMT, присоединяет к одному из его концов небольшую химическую группу. Этого не происходит, если блокировать действие ICMT. Чтобы проверить это, группа биологов из Сингапура, сотрудничающая с гётеборгской командой, разработала потенциальный ингибитор (блокатор) ICMT.
Ученые работали на мышиной модели прогерии: генетически измененные мыши, которые несли мутантный ген, преждевременно старели, так же как и люди.
«Когда мы с помощью этого препарата уменьшили производство фермента у мышей с мутантным геном Imna, — говорит профессор Бергё, — все клинические симптомы прогерии у них либо существенно ослабли, либо исчезли вообще.
Мы также исследовали культуры клеток, взятых у детей с прогерией, и обнаружили, что, когда фермент подавлен, клетки начинают расти быстрее, точно так же, как это происходило с культурами мышиных клеток, причем и в том и в другом случае механизм процесса был одним и тем же.
Это, конечно, не означает, что разработанным в Сингапуре лекарством уже завтра можно лечить детей, больных прогерией. По словам Бергё, пока исследования проводятся только на мышах.
Как уже говорилось, синдром Хатчисона — Гилфорда — не просто редкое, а редчайшее заболевание.
Сейчас во всем мире им болеют всего около ста детей.
Конечно, для их родителей будет великим счастьем избавить маленьких старичков от страшной судьбы, но не только этим объясняется чрезвычайный интерес, проявленный к исследованию в научном сообществе.
«Причина этого интереса очевидна, — утверждает профессор Бергё. — Это необычайное сходство между ходом нормального процесса старения и ускоренного старения у больных прогерией детей, а это значит, что прогерия может прояснить многие тайны и нормального старения.
У детей развивается остеопороз, мышечная слабость, инфаркт миокарда, инсульт — все как у старых людей, но у них никогда не бывает ни рака, ни слабоумия».
Продолжая эксперименты на мышах, группа Бергё именно с этой целью — разобраться не только с ускоренным, но и с обычным старением — исследует сейчас действие ингибитора ICMT на нормальных мышей.















Комментарии (1)