
Генетик, молекулярный биолог, заведующий лабораторией геномики и эпигеномики позвоночных Центра «Биоинженерия» РАН, Егор Борисович Прохорчук рассказал корреспонденту Pro Science о новейших методах тестирования эмбрионального развития и о сфере своих научных интересов.
Сегодня, получив возможность читать геном, мы обладаем огромной информацией - что с ней делать? Как этой информацией воспользоваться в жизни?
Буквально года четыре-пять назад открылась возможность читать много нуклеотидов, целыми геномами. Для фундаментальных исследований это неоспоримое преимущество: ученые анализируют много данных с точки зрения эволюционных задач, геномики и эпигеномики. Однако это породило и ряд проблем информационного плана - как хранить и передавать эту информацию. Как применить это новое знание к повседневной жизни – большой вопрос.
На конференции в Гейдельберге по раковому геному был приведен факт, что лишь немецкая часть гейдельбергского проекта генерирует пять с половиной терабайт информации в день! Для примера - твиттер генерирует порядка 12 терабайт, фейсбук – семь. Это есть некий вызов современному, не только научному, обществу – что с этой информацией делать?
Немецкая часть гейдельбергского проекта по раковому геному генерирует 5,5 терабайт информации в день, твиттер - порядка 12, фейсбук – 7. Но мы до конца не понимаем генетические тексты.
Сегодня технология определения последовательности генетических букв востребована во многих сферах жизни человека - это и криминалистика, и медицина, и история, и промышленность. Для решения этих задач мы читали по чуть-чуть, читали совсем небольшие участки ДНК. А читать много, целые геномы, и работать с этой информацией сегодня становится доступнее, но востребованность в обыкновенной жизни такого «чтения» невелика. Это связано в первую очередь с тем, что мы до конца не понимаем генетические тексты.
Однако по мере накопления наших знаний о генетических текстах утилитарность секвенирования будет только возрастать. Уже сегодня есть одно приложение, которое очень нужно людям и немыслимо без большого объема секвенирования. Так называемое «неинвазивное определение анеуплоидий плода». Речь идет о ранней диагностике беременностей, в которых плод несет хромосомные анеуплоидии. В первую очередь трисомии по 13, 18 и 21 хромосомам (трисомия по 21 хромосоме - синдром Дауна, по 18 – синдром Эдвардса, по 13 – синдром Патау - Полит.ру). Для такого анализа требуется только 5 мл крови матери. Забор крови можно сделать в клинике, не прибегая к госпитализации.
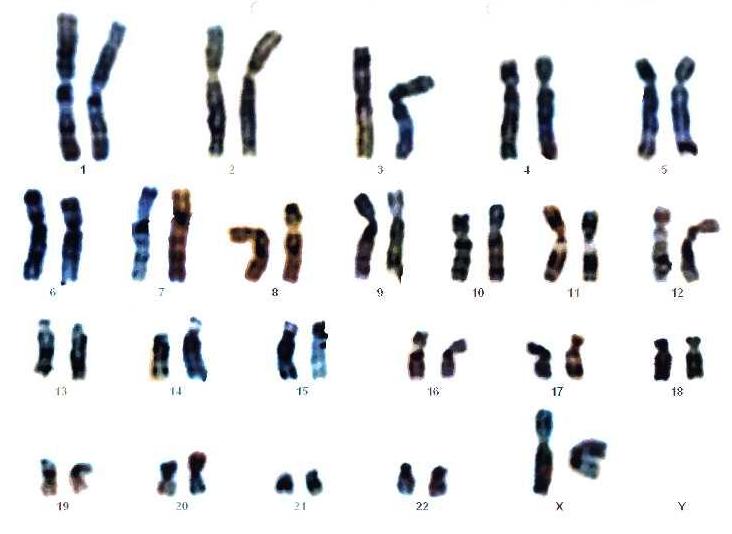
Хромосомный набор человека (женский)
В материнской крови помимо клеток - лимфоцитов, лейкоцитов, эритроцитов и прочих - есть небольшое количество свободной ДНК, которая образовалась в результате лизиса или апоптоза как клеток крови, так и клеток плаценты, которая, как известно, несет генотип плода (лизис - растворение, разрушение клеток и их систем – Полит. ру). Выделение свободно циркулирующей ДНК плода из кровотока матери позволяет анализировать количественный состав хромосом будущего ребенка. Конечно, в анализе присутствует и ДНК матери, в целом разделение генома матери и плода - это математическая задача. Оказывается, что около 95% свободно циркулирующей ДНК - это ДНК матери, и только 5% - это ДНК плода. Представьте, что у плода трисомия по 21 хромосоме, если все остальные хромосомы нормальны, то сколько «лишней» 21 хромосомы в общем анализе? - совсем чуть-чуть. Это чуть-чуть можно почувствовать статистически, для этого нужно набрать много данных. Считая все подряд, не прибегая к выборочному чтению генома, можно детектировать трисомию не только по 21 хромосоме, но и по 13-й, по 18-й, в которых чаще всего встречаются хромосомные аномалии у плода.
Есть американские, китайские, сингапурские компании, которые активно внедряют эту технологию на рынок, потому что это востребовано, поскольку безопасно и недорого, а главное - специфичность и чувствительность метода достигают почти 99%.
А что еще мы сможем узнать по геному?
Условно говоря, можно будет проводить некоторую ассоциацию между болезнями, между продолжительностью жизни и судьбой, между основными фенотипическими и генетическими характеристиками. Все это сложнейшие математические задачи по передаче, хранению и анализу информации. Анализируется три миллиарда параметров (а на самом деле больше, учитывая диплоидность генома, и мы не говорим об эпигенетической информации), с одной стороны, - и около сотни, а может, и больше фенотипических/медицинских параметров, с другой стороны. И нужно между ними найти некоторую ассоциацию.
Современный человек живет в информационном пространстве, он хочет знать все и обо всем. Эти же требования он предъявляет и к своему геному: человек хочет узнать по своему геному, что же с ним будет, заболеет ли он, что у него будет с головой, за кого он выйдет замуж. Конечно, на большинство из этих вопросов на сегодняшний день мы не имеем ответов. Только в редких случаях, смотря на геном, можно точно сказать, что ты заболеешь, чаще можно говорить о предрасположенности к определенному заболеванию.
Недавно я услышал, что правительство Британии поставило задачу по секвенированию 100 тысяч людей, в основном - больных. Это накопление больших объемов данных. Мы находимся в начале эры накопления этих знаний. Пока основной целью анализа этих данных является увеличение эффективности лечения болезней.
У меня есть ощущение, что в будущем будут секвенировать геномы каждого рожденного человека. Я не думаю, что в ближайшее время нам грозит какая-либо Гаттака (Gattaca - вышедший в 1997 году антиутопический триллер новозеландского режиссера Эндрю Никкола – Полит. ру). Но настанет ли время, когда будут проводить генетическое тестирование при приеме на работу и при страховании, - зависит от скорости технического прогресса в области секвенирования, доступности этой технологии для удовлетворения любых потребностей общества. По-моему, сейчас вы не можете застраховать свою жизнь на сумму свыше $2 млн. без прохождения генетического теста на болезнь Гентингтона, которую можно на 100% предсказать. Но это скорее редкое исключение такой монофакторной болезни, которая проявляется не с самого рождения, а в зрелом возрасте.
Уже сейчас возникает этический момент при анализе генома, и будет возникать все чаще и чаще, в связи с возможностью доступа к индивидуальной генетической информации. Европейское сообщество отслеживает здесь все очень точно. Вы можете депонировать геном, но о вашем имени в связи с вашим геномом никто не будет знать. Наверное, и европейцы, и американцы хотели бы иметь как можно больше геномов - обезличенных, но с историей болезни. Как сделать так, чтобы при этом не была раскрыта личная тайна человека, его семьи и их болячек?
Вы можете обозначить некоторые тренды в теоретическом плане и технологическом?
С точки зрения ближайших научных и научно-практических перспектив есть два направления. Первое - будет внедряться персональная терапия, в частности, в лечении рака, когда будет браться биопсия, устанавливаться генотип этой опухоли. Сейчас тратятся гигантские усилия на классификации опухолей. В зависимости от того, какой путь молекулярной сигнализации нарушен в опухоли, будет вестись целенаправленное воздействие именно на него. И это будет сугубо индивидуальный подход, вырабатываемый исходя из генотипа опухоли конкретного человека.
Учитывая тот факт, что гетерогенность рака очень большая, будут создаваться кластеры путей, которые нарушены в работе клетки опухоли. По этому критерию после кластеризации опухоли для каждой опухоли можно будет создать оптимальную терапию. Вот какая есть перспектива с раком.
Технологические перспективы: мономолекулярное секвенирование и секвенс белков.
Относительно технологической перспективы. С точки зрения ДНК - переход к мономолекулярному секвенированию. Самая простая история, когда у вас есть нанопора. Она может быть органическая или неорганическая, как дырка в каком-то полимере. Сквозь эту нанопору протаскиваем молекулу ДНК под действием электрического поля. Производим «съемку» того, как расстояния между атомами поры деформируются в зависимости от того, какая буква генетического алфавита через нее «пролезает». Это и будет мономолекулярное секвенирование. Имея большое количество таких пор и умея детектировать их деформации, вы можете читать генетические тексты, не прибегая к предварительной пробоподготовке, в первую очередь к ПЦР. Уход от этапа ПЦР потенциально может снизить количество ошибок в текстах, тех ошибок, которые сопряжены с амплификацией полимеразой (амплификация - процесс образования дополнительных копий участков хромосомной ДНК – Полит. ру). Это определенная технологическая перспектива вокруг ДНК.
Следующий возможный шаг - это секвенс белков. Сейчас мы говорим о генетической информации, на самом деле, не будучи реализована, информация мало чего стоит. Безусловно, мы болеем, или мы такие, как мы есть, потому что мы состоим из белков. Белки работают недостаточно эффективно, поскольку разрушен какой-то ферментативный центр. Поэтому секвенс белков, а еще лучше - со всем многообразием их модификаций, т.е. чтение аминокислотных текстов - это следующий шаг.
Однако технологически это выглядит проблематично. Дело в том, что в основе любой манипуляции с ДНК лежит полимеразная цепная реакция (ПЦР). Любую молекулу вы можете размножить до микрограммов, до разумного количества, которым можно манипулировать в лаборатории. С белками ничего подобного нет. Появление технологии одномолекулярного секвенирования с одной молекулой без её амплификации рождает надежду, что и белки можно будет секвенировать. Однако белки несут массу модификаций, что будет влиять на вариации в «дыхании» нанопоры при протаскивании аминокислоты. А белковых модификаций тоже немало. Но если научиться это делать, то перспективы открываются просто великие.
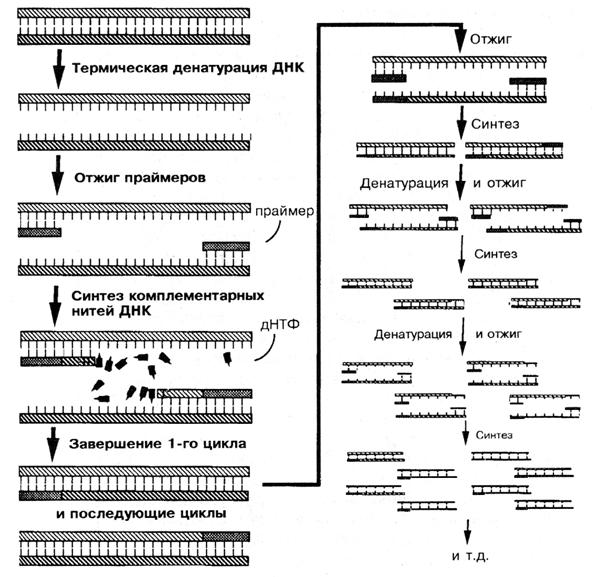
Схема полимеразной цепной реакции
Клетка состоит из липидной мембраны, внутри которой много белков. ДНК - это небольшая часть, она лишь хранит информацию. На ней хранится информация о белках, как устав. Устав – это текст, это ДНК, а что ты делаешь, это и есть белки.
Хорошо, попрошу тогда ваш краткий футуристический прогноз.
Мой прогноз - это переход к одномолекулярному секвенироваию ДНК, это упростит проблему работы с очень низкой концентрацией ДНК, во многом, даже при работе с ПЦРом вы можете вносить ошибку. Если эта технология начнет работать, то её смогут адаптировать и для белковых секвенсов.
Что касается медицины, того, что интересует людей, то актуальнейший вопрос - понять генетикумультифакториальных заболеваний, где много факторов, и не только генетических. Если станет понятно, что генетика играет хоть какую-то серьезную роль в причинах, скажем, инфаркта, если это будет доказано, то тогда это может влиять на весь образ жизни человека. Медицина станет персональной. Это станет медициной здорового образа жизни. Станет возможным предсказывать болезни, а не лечить пациента постфактум.
Егор, мы много говорили о технологиях, скажите, а что вас интересует в сфере идей, что для вас здесь наиболее значимо?
Таких гигантских подвижек, как открытие генетического кода, открытие ДНК, таких изменений не может быть много. Изменения не столь масштабны, как открытие Уотсоном и Криком спирали ДНК, когда мир поменялся. Но, скажем, около семи лет назад открыто целое направление - интерференция РНК.
Мой основной интерес - в области эпигенетики, то на чем я рос, и что всегда меня интересовало. Молекулярные проблемы памяти, молекулярные проблемы сознания – интереснейшая сфера. Это в какой-то мере связано с эпигенетикой, некоторые ученые говорят, что это связано с гистоновым кодом в конкретном нейроне, и, собственно, с теми технологиями, которые появляются по анализу генетического материала одной клетки, это все можно пробовать делать.
То, что связано со стволовыми клетками и перепрограммированием клеток, когда можно взять соматическую клетку, когда её можно потом дифференцировать и делать «запасные части», - здесь есть масса проблем, но и перспективы. Все соматическое перепрограммирование напрямую связано с изменением и переписыванием эпигенетической информации.
Следующее интереснейшее направление: люди научились редактировать геном. Скажем, есть мутация, которая приводит к какой-то болезни. Можно взять соматическую клетку, вначале перепрограммировать, превратив в индуцированную плюрипотентную, а после устранить в её генетическом материале единственную мутацию. Получается, что это ваш геном, за исключением одной вредной мутации. Впоследствии отредактированные стволовые клетки можно дифференцировать в пораженный болезнью тип ткани и пытаться проводить с их помощью клеточную терапию.
Но и сейчас происходят очень интересные вещи. Меняются представления о том, как произошел современный человек. Мы понимаем, кто такие неандертальцы, какой вклад они внесли в формирование современного человека. Мы можем предполагать прародину первых индоевропейцев.
В конкретной области знания по молекулярной биологии происходит много интересного. К сожалению, наша страна не очень сильно участвует в формировании этого знания. Но перефразирую слова моего коллеги – до тех пор, пока мы можем читать и понимать, что пишут в ведущих научных изданиях, до тех пор мы можем считать себя причастными к этой цивилизации.
Время жизни статей в журнале уровня Nature катастрофически сокращается. Если посмотреть, кто ссылается на статьи 2003-2005 гг., то ссылаются на единичные статьи. Для большинства статей есть пик цитирования, ширина этого пика на полувысоте очень невелика и постоянно сокращается. У меня есть ощущение, что зачастую публикации в топовых западных журналах продиктованы соображениями моды и научного политиканства. Люди пытаются опубликовать любой ценой свои результаты, людям нужно продлевать свои гранты. Что будет дальше, если мы еще увеличим разрешение научного знания? Возникнет ли что-то принципиально новое в основных блоках: ДНК – это носитель генетической информации, потом считывание РНК, потом белок? Возникнет ли новая наука на базе классической молекулярной биологии, как возникла квантовая физика на фундаменте ньютоновских и максвелловских законов классической физики?
Обязательно нужно в какой-то момент остановиться и отдышаться в этой гонке за публикациями, за конкретным продлением своего гранта. Хочется посмотреть не только на свою конкретную нору, которую ты продолбил в этом граните науки, но посмотреть, как это выглядит вообще, посмотреть на это общее знание. Готово ли общество переварить то количество информации, которое мы ему готовы дать? Что общество будет делать с геномами? Возможно, общество не поспевает за тем прогрессом, который есть в геномике. Под обществом подразумеваются политики, социологи, философы. Они не успевают осмыслять эту картинку. Что это значит для человека, для его воспроизводства, для формирования семьи? Очевидно же, что поведенческие модели за последние сто лет кардинально поменялись, произошло разрушение традиционного общества.
Геномная информация – не реальная ли это Гаттака?
Что будет, если меня не примут на работу на основании геномной информации? Правда ли это? Или ученые - как священники, может быть, они все выдумали и ничего этого не существует? Может быть, это фикция, а на самом деле меня просто дискриминируют? Но мы столкнемся и с социальными страхами, и с поведенческими фобиями, вызванными геномной информационной революцией.
Теоретическое знание проверяется экспериментально, но все равно технологии так быстро продвигаются, что большинство населения всегда будет воспринимать все на веру.
Как быть с этим?
Общество должно переваривать информацию этой геномной революции.
Мы с вами совсем не поговорили о минимальных геномах, о создании новой жизни. Пока речь идет о микобактериях, небольших организмах, которые мы можем формировать, вначале прийти к минимальному геному, а после насыщать геном полезными свойствами. Это такая же история, как с телевизором, с ядерной энергией, как любое достижение разума и цивилизации, вы можете как использовать это во благо, так и повернуть во вред человеку.
Вокруг геномики еще и много политики.
Китайская компания Beijing Genomics Institute (BGI) – Пекинский геномный институт, хотя сидят они рядом с Гонконгом - сейчас это частная компания, это гигантская фабрика по секвенированию. Там больше сотни мощнейших секвенаторов, и все они произведены практически одной компанией – Illumina, практически монополистом на рынке секвенаторов. То, что потребляет Пекинский геномный институт, составляет треть выручки Illumina. И вдруг у BGI возник интерес к американской компании Complete Genomics, которая в какой-то мере конкурент Illumina. Китайцы предложили за Complete Genomics 117 млн. долларов, а Illumina предложила 120 млн. Но Complete Genomics решила пойти к китайцам, тогда Illumina обратилась в Госдепартамент США, сказав, что китайцы будут создавать биооружие и будут уничтожать американских людей. Сделка была заморожена по политическим мотивам. BGI оказался в такой ситуации, что Illumina прекратил поставки реактивов, у них как-то остановилась жизнь. Но и для Illumina это плохо, потому что они теряют треть своего оборота. (Вся эта ситуация по состоянию на декабрь 2012 - январь 2013 года, сейчас я не очень слежу, чем это закончилось… - ЕП).
Ситуация требует осмысления. И, естественно, решение принимали не ученые, которые понимают, что до создания биооружия как до Луны, а политики, которые живут и мыслят совсем иными категориями. Насколько общество готово к таким коллизиям – вопрос.
Люди должны понимать, что они входят в реальность, где есть (будет) клонирование человеческих организмов и огромный поток геномной информации. Воспроизведение перестало быть темой только для фантастов. Нам нужно думать об этом, поскольку технологически мы развиваемся быстрыми темпами, а осмыслять не успеваем.
http://www.polit.ru/article/2013/04/22/ps_prokhorchuk2/
Сегодня, получив возможность читать геном, мы обладаем огромной информацией - что с ней делать? Как этой информацией воспользоваться в жизни?
Буквально года четыре-пять назад открылась возможность читать много нуклеотидов, целыми геномами. Для фундаментальных исследований это неоспоримое преимущество: ученые анализируют много данных с точки зрения эволюционных задач, геномики и эпигеномики. Однако это породило и ряд проблем информационного плана - как хранить и передавать эту информацию. Как применить это новое знание к повседневной жизни – большой вопрос.
На конференции в Гейдельберге по раковому геному был приведен факт, что лишь немецкая часть гейдельбергского проекта генерирует пять с половиной терабайт информации в день! Для примера - твиттер генерирует порядка 12 терабайт, фейсбук – семь. Это есть некий вызов современному, не только научному, обществу – что с этой информацией делать?
Немецкая часть гейдельбергского проекта по раковому геному генерирует 5,5 терабайт информации в день, твиттер - порядка 12, фейсбук – 7. Но мы до конца не понимаем генетические тексты.
Сегодня технология определения последовательности генетических букв востребована во многих сферах жизни человека - это и криминалистика, и медицина, и история, и промышленность. Для решения этих задач мы читали по чуть-чуть, читали совсем небольшие участки ДНК. А читать много, целые геномы, и работать с этой информацией сегодня становится доступнее, но востребованность в обыкновенной жизни такого «чтения» невелика. Это связано в первую очередь с тем, что мы до конца не понимаем генетические тексты.
Однако по мере накопления наших знаний о генетических текстах утилитарность секвенирования будет только возрастать. Уже сегодня есть одно приложение, которое очень нужно людям и немыслимо без большого объема секвенирования. Так называемое «неинвазивное определение анеуплоидий плода». Речь идет о ранней диагностике беременностей, в которых плод несет хромосомные анеуплоидии. В первую очередь трисомии по 13, 18 и 21 хромосомам (трисомия по 21 хромосоме - синдром Дауна, по 18 – синдром Эдвардса, по 13 – синдром Патау - Полит.ру). Для такого анализа требуется только 5 мл крови матери. Забор крови можно сделать в клинике, не прибегая к госпитализации.

Хромосомный набор человека (женский)
В материнской крови помимо клеток - лимфоцитов, лейкоцитов, эритроцитов и прочих - есть небольшое количество свободной ДНК, которая образовалась в результате лизиса или апоптоза как клеток крови, так и клеток плаценты, которая, как известно, несет генотип плода (лизис - растворение, разрушение клеток и их систем – Полит. ру). Выделение свободно циркулирующей ДНК плода из кровотока матери позволяет анализировать количественный состав хромосом будущего ребенка. Конечно, в анализе присутствует и ДНК матери, в целом разделение генома матери и плода - это математическая задача. Оказывается, что около 95% свободно циркулирующей ДНК - это ДНК матери, и только 5% - это ДНК плода. Представьте, что у плода трисомия по 21 хромосоме, если все остальные хромосомы нормальны, то сколько «лишней» 21 хромосомы в общем анализе? - совсем чуть-чуть. Это чуть-чуть можно почувствовать статистически, для этого нужно набрать много данных. Считая все подряд, не прибегая к выборочному чтению генома, можно детектировать трисомию не только по 21 хромосоме, но и по 13-й, по 18-й, в которых чаще всего встречаются хромосомные аномалии у плода.
Есть американские, китайские, сингапурские компании, которые активно внедряют эту технологию на рынок, потому что это востребовано, поскольку безопасно и недорого, а главное - специфичность и чувствительность метода достигают почти 99%.
А что еще мы сможем узнать по геному?
Условно говоря, можно будет проводить некоторую ассоциацию между болезнями, между продолжительностью жизни и судьбой, между основными фенотипическими и генетическими характеристиками. Все это сложнейшие математические задачи по передаче, хранению и анализу информации. Анализируется три миллиарда параметров (а на самом деле больше, учитывая диплоидность генома, и мы не говорим об эпигенетической информации), с одной стороны, - и около сотни, а может, и больше фенотипических/медицинских параметров, с другой стороны. И нужно между ними найти некоторую ассоциацию.
Современный человек живет в информационном пространстве, он хочет знать все и обо всем. Эти же требования он предъявляет и к своему геному: человек хочет узнать по своему геному, что же с ним будет, заболеет ли он, что у него будет с головой, за кого он выйдет замуж. Конечно, на большинство из этих вопросов на сегодняшний день мы не имеем ответов. Только в редких случаях, смотря на геном, можно точно сказать, что ты заболеешь, чаще можно говорить о предрасположенности к определенному заболеванию.
Недавно я услышал, что правительство Британии поставило задачу по секвенированию 100 тысяч людей, в основном - больных. Это накопление больших объемов данных. Мы находимся в начале эры накопления этих знаний. Пока основной целью анализа этих данных является увеличение эффективности лечения болезней.
У меня есть ощущение, что в будущем будут секвенировать геномы каждого рожденного человека. Я не думаю, что в ближайшее время нам грозит какая-либо Гаттака (Gattaca - вышедший в 1997 году антиутопический триллер новозеландского режиссера Эндрю Никкола – Полит. ру). Но настанет ли время, когда будут проводить генетическое тестирование при приеме на работу и при страховании, - зависит от скорости технического прогресса в области секвенирования, доступности этой технологии для удовлетворения любых потребностей общества. По-моему, сейчас вы не можете застраховать свою жизнь на сумму свыше $2 млн. без прохождения генетического теста на болезнь Гентингтона, которую можно на 100% предсказать. Но это скорее редкое исключение такой монофакторной болезни, которая проявляется не с самого рождения, а в зрелом возрасте.
Уже сейчас возникает этический момент при анализе генома, и будет возникать все чаще и чаще, в связи с возможностью доступа к индивидуальной генетической информации. Европейское сообщество отслеживает здесь все очень точно. Вы можете депонировать геном, но о вашем имени в связи с вашим геномом никто не будет знать. Наверное, и европейцы, и американцы хотели бы иметь как можно больше геномов - обезличенных, но с историей болезни. Как сделать так, чтобы при этом не была раскрыта личная тайна человека, его семьи и их болячек?
Вы можете обозначить некоторые тренды в теоретическом плане и технологическом?
С точки зрения ближайших научных и научно-практических перспектив есть два направления. Первое - будет внедряться персональная терапия, в частности, в лечении рака, когда будет браться биопсия, устанавливаться генотип этой опухоли. Сейчас тратятся гигантские усилия на классификации опухолей. В зависимости от того, какой путь молекулярной сигнализации нарушен в опухоли, будет вестись целенаправленное воздействие именно на него. И это будет сугубо индивидуальный подход, вырабатываемый исходя из генотипа опухоли конкретного человека.
Учитывая тот факт, что гетерогенность рака очень большая, будут создаваться кластеры путей, которые нарушены в работе клетки опухоли. По этому критерию после кластеризации опухоли для каждой опухоли можно будет создать оптимальную терапию. Вот какая есть перспектива с раком.
Технологические перспективы: мономолекулярное секвенирование и секвенс белков.
Относительно технологической перспективы. С точки зрения ДНК - переход к мономолекулярному секвенированию. Самая простая история, когда у вас есть нанопора. Она может быть органическая или неорганическая, как дырка в каком-то полимере. Сквозь эту нанопору протаскиваем молекулу ДНК под действием электрического поля. Производим «съемку» того, как расстояния между атомами поры деформируются в зависимости от того, какая буква генетического алфавита через нее «пролезает». Это и будет мономолекулярное секвенирование. Имея большое количество таких пор и умея детектировать их деформации, вы можете читать генетические тексты, не прибегая к предварительной пробоподготовке, в первую очередь к ПЦР. Уход от этапа ПЦР потенциально может снизить количество ошибок в текстах, тех ошибок, которые сопряжены с амплификацией полимеразой (амплификация - процесс образования дополнительных копий участков хромосомной ДНК – Полит. ру). Это определенная технологическая перспектива вокруг ДНК.
Следующий возможный шаг - это секвенс белков. Сейчас мы говорим о генетической информации, на самом деле, не будучи реализована, информация мало чего стоит. Безусловно, мы болеем, или мы такие, как мы есть, потому что мы состоим из белков. Белки работают недостаточно эффективно, поскольку разрушен какой-то ферментативный центр. Поэтому секвенс белков, а еще лучше - со всем многообразием их модификаций, т.е. чтение аминокислотных текстов - это следующий шаг.
Однако технологически это выглядит проблематично. Дело в том, что в основе любой манипуляции с ДНК лежит полимеразная цепная реакция (ПЦР). Любую молекулу вы можете размножить до микрограммов, до разумного количества, которым можно манипулировать в лаборатории. С белками ничего подобного нет. Появление технологии одномолекулярного секвенирования с одной молекулой без её амплификации рождает надежду, что и белки можно будет секвенировать. Однако белки несут массу модификаций, что будет влиять на вариации в «дыхании» нанопоры при протаскивании аминокислоты. А белковых модификаций тоже немало. Но если научиться это делать, то перспективы открываются просто великие.

Схема полимеразной цепной реакции
Клетка состоит из липидной мембраны, внутри которой много белков. ДНК - это небольшая часть, она лишь хранит информацию. На ней хранится информация о белках, как устав. Устав – это текст, это ДНК, а что ты делаешь, это и есть белки.
Хорошо, попрошу тогда ваш краткий футуристический прогноз.
Мой прогноз - это переход к одномолекулярному секвенироваию ДНК, это упростит проблему работы с очень низкой концентрацией ДНК, во многом, даже при работе с ПЦРом вы можете вносить ошибку. Если эта технология начнет работать, то её смогут адаптировать и для белковых секвенсов.
Что касается медицины, того, что интересует людей, то актуальнейший вопрос - понять генетикумультифакториальных заболеваний, где много факторов, и не только генетических. Если станет понятно, что генетика играет хоть какую-то серьезную роль в причинах, скажем, инфаркта, если это будет доказано, то тогда это может влиять на весь образ жизни человека. Медицина станет персональной. Это станет медициной здорового образа жизни. Станет возможным предсказывать болезни, а не лечить пациента постфактум.
Егор, мы много говорили о технологиях, скажите, а что вас интересует в сфере идей, что для вас здесь наиболее значимо?
Таких гигантских подвижек, как открытие генетического кода, открытие ДНК, таких изменений не может быть много. Изменения не столь масштабны, как открытие Уотсоном и Криком спирали ДНК, когда мир поменялся. Но, скажем, около семи лет назад открыто целое направление - интерференция РНК.
Мой основной интерес - в области эпигенетики, то на чем я рос, и что всегда меня интересовало. Молекулярные проблемы памяти, молекулярные проблемы сознания – интереснейшая сфера. Это в какой-то мере связано с эпигенетикой, некоторые ученые говорят, что это связано с гистоновым кодом в конкретном нейроне, и, собственно, с теми технологиями, которые появляются по анализу генетического материала одной клетки, это все можно пробовать делать.
То, что связано со стволовыми клетками и перепрограммированием клеток, когда можно взять соматическую клетку, когда её можно потом дифференцировать и делать «запасные части», - здесь есть масса проблем, но и перспективы. Все соматическое перепрограммирование напрямую связано с изменением и переписыванием эпигенетической информации.
Следующее интереснейшее направление: люди научились редактировать геном. Скажем, есть мутация, которая приводит к какой-то болезни. Можно взять соматическую клетку, вначале перепрограммировать, превратив в индуцированную плюрипотентную, а после устранить в её генетическом материале единственную мутацию. Получается, что это ваш геном, за исключением одной вредной мутации. Впоследствии отредактированные стволовые клетки можно дифференцировать в пораженный болезнью тип ткани и пытаться проводить с их помощью клеточную терапию.
Но и сейчас происходят очень интересные вещи. Меняются представления о том, как произошел современный человек. Мы понимаем, кто такие неандертальцы, какой вклад они внесли в формирование современного человека. Мы можем предполагать прародину первых индоевропейцев.
В конкретной области знания по молекулярной биологии происходит много интересного. К сожалению, наша страна не очень сильно участвует в формировании этого знания. Но перефразирую слова моего коллеги – до тех пор, пока мы можем читать и понимать, что пишут в ведущих научных изданиях, до тех пор мы можем считать себя причастными к этой цивилизации.
Время жизни статей в журнале уровня Nature катастрофически сокращается. Если посмотреть, кто ссылается на статьи 2003-2005 гг., то ссылаются на единичные статьи. Для большинства статей есть пик цитирования, ширина этого пика на полувысоте очень невелика и постоянно сокращается. У меня есть ощущение, что зачастую публикации в топовых западных журналах продиктованы соображениями моды и научного политиканства. Люди пытаются опубликовать любой ценой свои результаты, людям нужно продлевать свои гранты. Что будет дальше, если мы еще увеличим разрешение научного знания? Возникнет ли что-то принципиально новое в основных блоках: ДНК – это носитель генетической информации, потом считывание РНК, потом белок? Возникнет ли новая наука на базе классической молекулярной биологии, как возникла квантовая физика на фундаменте ньютоновских и максвелловских законов классической физики?
Обязательно нужно в какой-то момент остановиться и отдышаться в этой гонке за публикациями, за конкретным продлением своего гранта. Хочется посмотреть не только на свою конкретную нору, которую ты продолбил в этом граните науки, но посмотреть, как это выглядит вообще, посмотреть на это общее знание. Готово ли общество переварить то количество информации, которое мы ему готовы дать? Что общество будет делать с геномами? Возможно, общество не поспевает за тем прогрессом, который есть в геномике. Под обществом подразумеваются политики, социологи, философы. Они не успевают осмыслять эту картинку. Что это значит для человека, для его воспроизводства, для формирования семьи? Очевидно же, что поведенческие модели за последние сто лет кардинально поменялись, произошло разрушение традиционного общества.
Геномная информация – не реальная ли это Гаттака?
Что будет, если меня не примут на работу на основании геномной информации? Правда ли это? Или ученые - как священники, может быть, они все выдумали и ничего этого не существует? Может быть, это фикция, а на самом деле меня просто дискриминируют? Но мы столкнемся и с социальными страхами, и с поведенческими фобиями, вызванными геномной информационной революцией.
Теоретическое знание проверяется экспериментально, но все равно технологии так быстро продвигаются, что большинство населения всегда будет воспринимать все на веру.
Как быть с этим?
Общество должно переваривать информацию этой геномной революции.
Мы с вами совсем не поговорили о минимальных геномах, о создании новой жизни. Пока речь идет о микобактериях, небольших организмах, которые мы можем формировать, вначале прийти к минимальному геному, а после насыщать геном полезными свойствами. Это такая же история, как с телевизором, с ядерной энергией, как любое достижение разума и цивилизации, вы можете как использовать это во благо, так и повернуть во вред человеку.
Вокруг геномики еще и много политики.
Китайская компания Beijing Genomics Institute (BGI) – Пекинский геномный институт, хотя сидят они рядом с Гонконгом - сейчас это частная компания, это гигантская фабрика по секвенированию. Там больше сотни мощнейших секвенаторов, и все они произведены практически одной компанией – Illumina, практически монополистом на рынке секвенаторов. То, что потребляет Пекинский геномный институт, составляет треть выручки Illumina. И вдруг у BGI возник интерес к американской компании Complete Genomics, которая в какой-то мере конкурент Illumina. Китайцы предложили за Complete Genomics 117 млн. долларов, а Illumina предложила 120 млн. Но Complete Genomics решила пойти к китайцам, тогда Illumina обратилась в Госдепартамент США, сказав, что китайцы будут создавать биооружие и будут уничтожать американских людей. Сделка была заморожена по политическим мотивам. BGI оказался в такой ситуации, что Illumina прекратил поставки реактивов, у них как-то остановилась жизнь. Но и для Illumina это плохо, потому что они теряют треть своего оборота. (Вся эта ситуация по состоянию на декабрь 2012 - январь 2013 года, сейчас я не очень слежу, чем это закончилось… - ЕП).
Ситуация требует осмысления. И, естественно, решение принимали не ученые, которые понимают, что до создания биооружия как до Луны, а политики, которые живут и мыслят совсем иными категориями. Насколько общество готово к таким коллизиям – вопрос.
Люди должны понимать, что они входят в реальность, где есть (будет) клонирование человеческих организмов и огромный поток геномной информации. Воспроизведение перестало быть темой только для фантастов. Нам нужно думать об этом, поскольку технологически мы развиваемся быстрыми темпами, а осмыслять не успеваем.
http://www.polit.ru/article/2013/04/22/ps_prokhorchuk2/















Комментарии (0)