
С. Д. Варфоломеев, Ю. М. Евдокимов, М. А. Островский
Варфоломеев Сергей Дмитриевич - доктор химических наук, заведующий кафедрой химической энзимологии Московского государственного университета.
Евдокимов Юрий Михайлович - доктор химических наук, заведующий лабораторией Института молекулярной биологии РАН.
Островский Михаил Аркадьевич - академик, заведующий лабораторией Института биохимической физики РАН
Сенсорные системы, или органы чувств (в старой, более известной терминологии), обеспечивают организм информацией об окружающем мире и внутреннем состоянии самого организма. По существу, органы чувств способны воспринимать и преобразовывать сигналы трех модальностей: электромагнитные поля в видимой (зрение) и инфракрасной (температурная чувствительность) областях спектра; механические возмущения - звуковые волны (слух), силу тяжести (гравитационная и вестибулярная чувствительность), механическое давление (осязание); химические сигналы -обнаружение веществ в жидкой фазе (вкус) и в газовой фазе (обоняние).
Возникает вопрос: способен ли человек выйти за рамки сенсорных возможностей, данных ему природой? Может ли он, непосредственно используя свои органы чувств, регистрировать электромагнитные поля не только в видимом диапазоне, но и в области ультрафиолетового, рентгеновского или радиационного излучений? Может ли с помощью сенсорных систем детектировать в окружающей среде вещества, для которых не существует естественных рецепторных механизмов? Наконец, можно ли ожидать появления "искусственных" интерорецепторных сенсорных систем, ориентированных на "внутреннее зрение" - обнаружение, регистрацию и контроль ключевых метаболитов, определяющих согласованность биохимических механизмов в норме, и их нарушение при различных патологиях? Ответ на последний вопрос важен потому, что человек лишен "внутреннего биохимического зрения", его собственная система интерорецепции, в том числе система болевой информации, недостаточно совершенна. Зачастую болевой сигнал возникает лишь на необратимых стадиях патологического процесса.
В декабре 1995 г. в Санкт-Петербурге на встрече российских и американских ученых обсуждались физиологические механизмы работы сенсорных систем и новые подходы к созданию биосенсоров и новых биосенсорных технологий (материалы совещания опубликованы в специальных выпусках журнала "Сенсорные системы" [1]). В ходе совещания стало очевидным, что формируется междисциплинарное научно-технологическое направление под условным названием "Сенсорная биология и новые сенсорные технологии". Его задачи: сравнить возможности сенсорных систем организмов (органов чувств) и биосенсоров, установить, реально ли применение современных знаний о принципах организации и функционирования органов чувств для создания новых сенсорных технологий.
БИОТИЧЕСКИЕ СЕНСОРНЫЕ СИСТЕМЫ
Сенсорные системы организма удовлетворяют самым строгим информационным требованиям: с высокой точностью различают стимулы различных модальностей, воспринимают изменения силы стимула в широких диапазонах, обладают предельно высокой чувствительностью, которую только допускают законы физики и химии, и при этом способны регулировать свою чувствительность (адаптация).
Что касается абсолютной чувствительности, то адекватный стимул, то есть стимул, воспринимаемый специализированной рецепторной клеткой, как правило, лишь незначительно превышает уровень энергии тепловых шумов молекул. Именно такого абсолютного порога чувствительности достигают стимулы, равные энергии одного кванта видимого света, фонона или электрического напряжения, не превышающего 10 нВ/см, для зрительной, слуховой и электрорецепторной клеток соответственно. В случае хеморецепции (обоняния) многие органические соединения воспринимаются в концентрации менее 10-12 молекул в одном литре. Классическим примером может служить обонятельная клетка самца шелкопряда, способная обнаружить в воздухе одну-единственную молекулу полового аттрактанта (феромона).
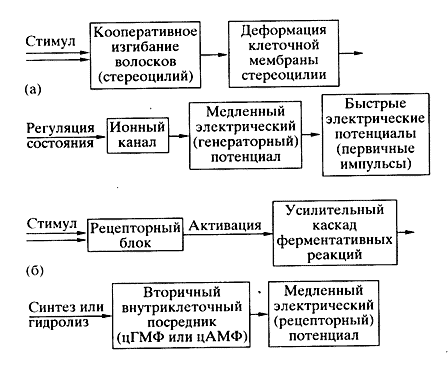
Рис. 1. Схема сенсорной транедукции - преобразование в рецепторной клетке энергии внешнего стимула в электрический сигнал: а - прямая трансдукция без участия внутриклеточного посредника (механорецепция); б - опосредованная трансдукция с участием внутриклеточного посредника (фото- и хеморецепция)
Рецепторная клетка воспринимает сигнал определенной модальности и преобразует его в электрический ответ - сравнительно медленный рецепторный или генераторный электрический потенциал (рис. 1). Специализированные рецепторные клетки непосредственно либо через промежуточные нейроны кодируют и передают сенсорную информацию в мозг электрическим способом - универсальным языком нервных импульсов. После обработки мозгом сенсорной информации немедленно формируются выходные команды или происходит "запись" в память для будущего использования.
В информационных терминах рецепторные клетки - это высокоспециализированные "датчики", предназначенные для восприятия сигналов различной модальности извне или изнутри организма. К внешним стимулам относятся свет, различного рода механические возмущения, включая звук, химические вещества, изменения температуры, электрического поля. Стимулами внутренней среды организма служат механические сигналы (изменение кровяного давления, степени натяжения мышцы или сухожилия), колебания температуры тела или органа, разнообразнейшие химические вещества.
Сенсорный рецептор можно рассматривать как аналоговый преобразователь. В одних клетках, например в механорецепторах, возникают и медленный генераторный потенциал, и быстрые нервные импульсы, обеспечивающие дальнюю связь - передачу сенсорной информации в мозг. В других клетках, например зрительных, нервные импульсы не возникают, а световой сигнал преобразуется только в медленный рецепторный электрический потенциал, который затем через первый фоторецепторный синапс передается следующим нейронам сетчатки.
В конечном же итоге после переработки информации в сетчатке ее нейроны (ганглиозные клетки) посылают в мозг "зрительную" информацию, представляющую собой последовательность нервных импульсов. Итак, в рецепторной клетке внешний сигнал соответствующей модальности сначала преобразуется в рецепторный (или генераторный) потенциал, который, в свою очередь, вызывает последовательность нервных импульсов в этой же или соседней клетке.
Сенсорные рецепторы делятся на статические и динамические. Статические непрерывно и с постоянной частотой посылают в мозг информацию о значении некой физической величины, например кровяного давления. Динамические реагируют лишь на изменение величины сигнала, например зрительные клетки - на колебания интенсивности светового потока, тактильные - на колебания силы давления на кожу.
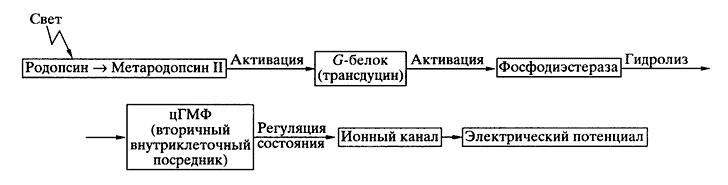
Рис. 2. Схема фототрансдукции
Принципиально важным свойством сенсорных рецепторов является нелинейность (логарифмическая зависимость) преобразования величины внешнего сигнала в рецепторный потенциал. В то же время рецепторный потенциал преобразуется в частоту нервных импульсов по линейному закону.
В ходе эволюции выработалось несколько способов, позволяющих рецепторным клеткам измерять сигнал, величина которого может различаться на много порядков. Во-первых, существует набор рецепторов с разной шкалой чувствительности. Примером могут служить высокочувствительные палочки и менее чувствительные к свету колбочки в сетчатке глаза. Во-вторых, нелинейность шкалы преобразования обеспечивает одну и ту же относительную чувствительность для сигналов разной величины. В-третьих, чувствительность рецептора изменяется (адаптируется) в зависимости от значения измеряемой величины. Возможна эфферентная регуляция чувствительности рецепторов со стороны центральной нервной системы.
Рассмотрим принцип работы сенсорного рецептора на примере слуховой (механический стимул) и зрительной (световой стимул) клеток [2,3]. В слуховой клетке электрический ответ (рецепторный потенциал) возникает в результате непосредственного действия стимула на ионные каналы, встроенные в ее клеточную мембрану. В зрительной же клетке рецепторный потенциал на ее мембране появляется опосредованно, благодаря поглощению света рецепторным белком и каскаду ферментативных реакций усиления светового сигнала.
Вызванная звуковыми волнами быстрая вибрация воспринимается пучком волосков (стереоцилий), расположенных на верхушке слуховой клетки. При их наклоне, обусловленном вибрацией, в клеточной мембране на кончике стереоцилии открываются ионные каналы, через которые в клетку устремляется ионный ток, называемый рецепторным. Иными словами, каналы стереоцилии способны механически регулировать свое открытое или закрытое состояние. Максимальная величина электрического ответа достигается в слуховой клетке за очень короткое время - 100-500 мкс. Это означает, что непосредственной причиной перехода канала в открытое состояние служит именно наклон - механическая деформация - стереоцилии.
Высочайшая чувствительность слуховой клетки объясняется тем, что собранные в пучок стереоцилии работают слаженно, как ансамбль. Они располагаются на верхушке клетки плотными рядами разной высоты, подобно трубам в органе. К тому же они связаны в пучок тонкими поперечными нитями цитоскелета и еще более тонкими нитями, почти вертикально направленными от верхушки короткой к кончику соседней, более длинной стереоцилии. Такая изящная микромеханическая система обеспечивает при наклоне одной стереоцилии одновременное смещение верхушек всех остальных. В результате не в одной, а одновременно во многих открываются встроенные в их мембрану ионные каналы.
В мембране каждой стереоцилии имеется от одного до пяти механорегулируемых каналов. Поскольку каждая слуховая клетка несет на себе около сотни стереоцилии, а в каждом Кортиевом органе внутреннего уха не более 3500 слуховых клеток, то оказывается, что всего около 4 млн. ионных каналов - молекулярных преобразователей механического смещения в электрический потенциал - обеспечивают нашу способность слышать. Таким образом, в слуховой клетке реализуется микромеханическая система усиления, состоящая в "параллельной" работе многих ионных каналов.
Благодаря описанной системе механоусиления самые слабые звуки, которые человек только в состоянии уловить, растягивают вертикальные нити, прикрепленные к верхушкам стереоцилии, в среднем всего на 0.04 нм. И тем не менее такого сверхмалого смещения достаточно для восприятия пороговых звуковых сигналов. Экспериментально показано, что сила, необходимая для открытия одного ионного канала в мембране стереоцилии, составляет примерно 2х10-13 Н.
Зрительную клетку стимулирует, естественно, свет, чувствительность к которому достигает одного фотона. Однако время возникновения в ней рецепторного потенциала намного (примерно в 100 раз) больше, чем в слуховой клетке. Объясняется это участием в механизме преобразования (трансдукции) светового сигнала каскада ферментативных реакций, усиливающего "входной" световой сигнал примерно в 10-100 тыс. раз.
Высокочувствительные к свету палочки (рецепторы сумеречного, монохроматического зрения) и гораздо менее чувствительные колбочки (рецепторы дневного, контрастного, цветового зрения) представляют собой набор фоторецеп-торных клеток с разной световой и спектральной чувствительностью. Механизмы их работы в принципе одинаковы, и последовательность вызванных светом событий такова (рис. 2).
Квант света поглощается молекулой зрительного пигмента - родопсина. Мембранный белок родопсин находится в "жидкой" фоторецепторной мембране (ее вязкость соизмерима с вязкостью оливкового масла) и испытывает быструю вращательную (около 20 мкс) и медленную латеральную диффузию (константа латеральной диффузии 3.5 ± 1.5х10-9 см2с-1).
Энергия поглощенного кванта тратится на единственную в процессе зрения фотохимическую реакцию - быструю (10-15 с) изомеризацию хромофорной группы родопсина (11-цис-ретиналя). Затем следуют темновые конформационные перестройки белковой части. В конечном счете образуется долгоживущий продукт - метародопсин II. При переходе родопсина в состояние мета-родопсина II в нем открывается активный центр, а именно центр связывания ГТФ-связывающего белка (G-белка). В случае зрительной рецепции он называется трансдуцином. Связывание с мета-родопсином II приводит к его активации. Одна молекула метародопсина II способна активировать примерно 500-1000 молекул трансдуцина в секунду. Это первый этап в ферментативном каскаде усиления светового сигнала.
Активированный трансдуцин, в свою очередь, взаимодействует и активирует другой белок каскада - цГМФ-фосфодиэстеразу, способную с высокой скоростью гидролизовать цГМФ (около 4000 молекул в секунду). Это второй этап в ферментативном каскаде. Падение концентрации свободного цГМФ в клетке приводит к освобождению "канального белка" от "сидевших" на нем молекул цГМФ. В темноте несколько связанных с "канальным белком" молекул цГМФ держали его в открытом состоянии. В отсутствие цГМФ канал переходит из темнового в световое, "закрытое" состояние. На один поглощенный палочкой квант в ее цитоплазме за секунду гидролизуется более 105 молекул цГМФ, что и приводит к кратковременному блокированию около 250 ионных каналов. Естественно, что такой процесс трансдукции не может быть быстрым, зато он позволяет зрительной клетке (палочке) выделять из шумов полезный сигнал - одиночный квант света.
Молекулярный механизм возвращения фоторецепторной клетки в темновое состояние не менее сложен. Свет, как выяснилось, запускает не только ферментативный каскад усиления сигналов, но и (с небольшой задержкой) ферментативный каскад восстановления темнового состояния. В последнем процессе участвуют несколько белков, в том числе родопсиновая киназа и арестин, инактивирующие метародопсин II.
Различия в "стратегии" слуховой и зрительной рецепции очевидны. В первом случае механическое смещение стереоцилии прямо передается на ионные каналы клеточной мембраны, заставляя их быстро открываться или закрываться, что вызывает де- или гиперполяризацию мембраны. В случае зрительной рецепции родопсин, поглотивший квант света, лишь запускает каскад ферментативных реакций, снижающих внутриклеточную концентрацию вторичного посредника - цГМФ. Посредник регулирует в мембране режим работы канала: его блокирование приводит к генерации гиперполяризационного потенциала - электрического ответа фоторецепторной клетки на свет.
Использование принципов работы сенсорных рецепторов, моделирование молекулярных механизмов, лежащих в основе их функционирования, может дать толчок для создания новых биосенсорных устройств.
БИОСЕНСОРЫ
По-видимому, первую попытку использовать молекулярные принципы работы сенсорных систем для решения задач сенсорной технологии предприняли в 1970 г. И.В. Березин, С.Д. Варфоломеев и К. Мартинек, смоделировавшие зрительную рецепцию в искусственных ферментных системах [4]. Активный центр протеолитического фермента (a-химотрипсина был модифицирован по серину-195 коричной кислоты в цис-конфигурации, что приводило к полной потере ферментативной активности. Фотохимическая цис-транс-изомеризация модификатора в активном центре фермента давала трансконформацию, быстрый гидролиз которой приводил к образованию актив; ного фермента. Ферментативное темновое "усиление" светового сигнала составило 106-107 крат. На этой основе был разработан высокочувствительный фотографический процесс - фотоэнзография.
Последнее десятилетие характеризуется интенсивным развитием сенсорных технологий. Они ориентированы на создание аналитических устройств, позволяющих получать информацию о свойствах различных сред (объектов) в форме электрического сигнала. В сенсорных технологиях селектирующий элемент способен выделить исследуемое вещество или физическое поле из хаоса родственных и преобразовать полученную информацию в электрический ответ, фиксируемый в цифровой или аналоговой форме. Наибольшее развитие имеют аналитические устройства, использующие в качестве селектирующего элемента биомакромолекулы-"биосенсоры" [5].
да устройств впервые высказали Л. Кларк и К. Лионе в 1962 г. [6]. Они предложили использовать ферментный электрод, то есть электрохимический датчик с иммобилизованным на его поверхности ферментом. За прошедшие десятилетия исследовано много подобных систем, некоторые из них получили промышленную реализацию.
Большинство биосенсоров ориентировано на анализ главным образом биологических жидкостей. Действительно, в крови находятся тысячи различных соединений. Задача заключается в том, чтобы быстро и эффективно определить концентрацию нужного соединения, например глюкозы. Для людей, страдающих диабетом, такой клинический анализ жизненно важен.
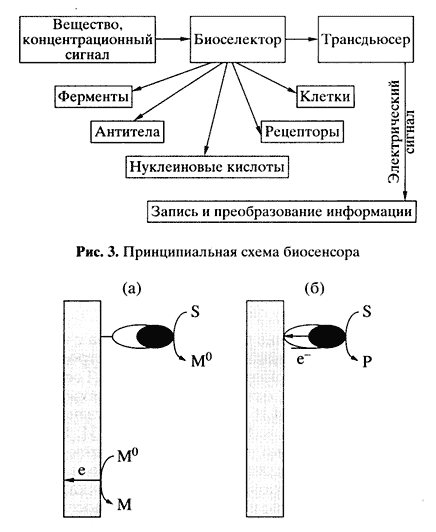
Любой биосенсор состоит из двух функциональных элементов: биодатчика, содержащего биоселектирующий материал, и физического преобразователя, трансформирующего любой генерируемый сигнал (концентрация ионов, масса, цвет и т.д.) в электрический. В роли биоселектирующего материала выступают все типы биологических структур - ферменты, антитела, рецепторы, нуклеиновые кислоты и даже живые клетки (рис. 3). В биосенсорах применяются электрохимические преобразователи (электроды), разные оптические преобразователи, гравитационные, калориметрические, резонансные системы. В принципе все виды биоселектирующих элементов можно комбинировать с разными преобразователями.
Рис. 4. Механизмы переноса электрона между активным центром фермента и электродом а - медиаторный перенос, б - прямой перенос
В статье невозможно сколь-нибудь подробно рассмотреть известные ныне типы биосенсоров, поэтому остановимся лишь на трех из них: ферментных, клеточных и на основе молекул ДНК.
Сопряжение ферментативно-каталитических и электрохимических реакций, происходящих на электронпроводящих материалах, позволило разработать биосенсоры для определения глюкозы, аминокислот, -молочного сахара, пирувата, мочевины и других метаболитов. Особенно удобно проводить измерения на ферментных электродах в амперометрическом режиме, то есть измерять силу тока (поток электронов, генерируемый в системе) через поверхность электрода. При этом сила тока должна быть пропорциональна концентрации анализируемого компонента.
Простейшая конструкция ферментного биосенсора реализуется при условии, когда либо субстрат, либо продукт ферментативной реакции электрохимически активен, иными словами, способен быстро (и желательно обратимо) окисляться или восстанавливаться на электроде при наложении на него соответствующего потенциала. Например, в биосенсоре для определения глюкозы с участием глюкозооксидазы используется реакция окисления глюкозы кислородом с образованием пероксида водорода, при этом регистрируется ток восстановления кислорода или пероксида водорода.
При иммобилизации ферментов на твердых поверхностях (металлы, керамика, полимеры) они, как правило, сохраняют свою структуру и каталитическую активность. Фермент в режиме амперометрического биосенсора проявляет электрокаталитическую активность, то есть ускоряет процесс обмена электронами между субстратом и электродом. Электрокаталитический транспорт электронов может быть осуществлен несколькими принципиально различными путями.
• Перенос электронов с участием диффузионно-подвижного промежуточного низкомолекулярного переносчика электронов - медиатора (рис. 4, а). Схему процесса в этом случае можно представить в виде
S + E Ю P + Eo
Eo + M Ю E + Mo
Mo Ю M - e-
где E и Eo- окисленная и восстановленная формы активного центра фермента; M и Mo - окисленная и восстановленная формы медиатора; S, Р - субстрат и продукт ферментативной реакции.
• Прямой электрокаталитический перенос электронов между электродом и активным центром фермента (рис. 4, б). Например, в атмосфере кислорода в присутствии медьсодержащей оксидазы - лакказы из Poluporoz versicolor, сорбированной на электродах из различных материалов, устанавливается потенциал, близкий к термодинамически равновесному для кислорода. В этом случае электроны перемещаются от электрода к активному центру фермента.
Впервые явление биоэлектрокатализа с участием прямого переноса электронов "электрод - активный центр фермента" было открыто (Госреестр открытий СССР, открытие № 316, приоритет от 1978 г.; авторы: И.В. Березин, В.А. Богдановская, С.Д. Варфоломеев, М.Р. Тарасович, А.И. Ярополов) и исследовано при изучении реакции электрохимического восстановления кислорода с участием медьсодержащей оксидазы - лакказы [7], затем пероксидазы и гидрогеназы. В биосенсорах наибольшее применение нашел феномен электровосстановления перекиси водорода с помощью иммобилизованной пероксидазы [8].
• Перенос электронов между активным центром фермента, встроенным в состав органических полупроводников ("органических металлов"), и доменами в полупроводнике.
Ферментные биосенсоры как аналитические устройства имеют различные области применения: медицинская диагностика, контроль технологических процессов, контроль качества и мониторинг окружающей среды. Рассмотрим несколько примеров.
Определение ключевых метаболитов. Многие ферменты катализируют окисление различных веществ (глюкоза, аминокислоты), при этом образуется пероксид водорода. Пероксидазный электрод используется для трансформации концентрационного сигнала в электрическую форму. При совместной иммобилизации двух ферментов - оксидазы и пероксидазы - проходят следующие процессы:
АH2 + 02 Ю A + H2O2 (оксидаза)
H202 Ю H2O + 2e- (пероксидаза в электрокаталитическом режиме),
где АH2 - окисляемый субстрат. В условиях, когда лимитирующей является первая стадия, величина тока линейно связана с концентрацией метаболита АH2
Определение супертоксинов и боевых отравляющих веществ. Большая группа фосфорорга-нических соединений выступает в роли сильных ядов, блокируя в центральной нервной системе фермент ацетилхолинэстеразу. Аналогично действует большинство пестицидов. Разработаны высокочувствительные биосенсоры для обнаружения таких соединений. В них используются следующие ферментативные реакции:
Ацетилхолин Ю холин + уксусная кислота (ацетилхолинэстераза)
Холин + 02 Ю H202 + оксихолин (холиноксидаза)
H202 Ю H2O + 2e- (пероксидаза в электрокаталитическом режиме),
Ингибитор (зарин, зоман, VJ блокирует активность ацетилхолинэстеразы, в конечном итоге уменьшая пероксидазный электрокаталитический ток через поверхность электрода. Чувствительность биосенсора доведена до 10-12 М. Ферментативные биосенсоры с высокой точностью определяют в анализируемой среде наличие, как правило, одного специфического вещества, являющегося субстратом для данного фермента.
В последние годы все больше внимания уделяется клеточным биосенсорам, позволяющим детектировать в среде группы химических соединений, нарушающих генетический аппарат клеток. Особый интерес вызывают биосенсоры на основе двухцепочечных нуклеиновых кислот [9, 10]. При их создании необходимо учитывать следующие характеристики этих молекул:
• правоспиральные двухцепочечные нуклеиновые кислоты существуют в различных пространственных формах (А-, В-, линейная, кольцевая, суперспиральная и т.д.), заметно различающихся по физико-химическим параметрам, переход между формами инициируется изменением свойств растворителя;
• двухцепочечные молекулы нуклеиновых кислот, отрицательно заряженные группы которых нейтрализованы противоионами, являются "жесткими", тогда как одноцепочечные нуклеиновые кислоты - "гибкими";
• нуклеиновые кислоты - оптически активные соединения;
• каждая цепь молекулы нуклеиновой кислоты содержит азотистые основания (хромофоры, поглощающие излучение в ультрафиолетовой области спектра), образующие комплементарные водородные связи с азотистыми основаниями другой цепи (комплементарное "узнавание");
• каждая цепь молекулы нуклеиновой кислоты имеет много химических групп, различающихся своей реакционной способностью;
• биологически активные соединения могут "узнавать" различные химические группы в составе нуклеиновых кислот; такое "узнавание" приводит к структурным изменениям, например к увеличению расстояния между азотистыми основаниями, изменению угла их наклона, образованию "сшивок" между основаниями, расщеплению сахарофосфатной цепи ДНК и т.д. (рис. 5).
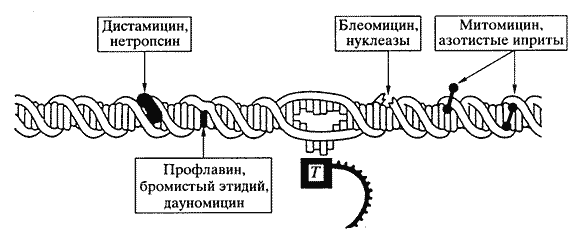
Рис. 5. Способы структурной адресовки биологически активных соединений двухцепочечной молекулой ДНК Биологически активные соединения располагаются в разных местах молекулы ДНК, вызывая при этом разное изменение ее физико-химических свойств, прежде всего оптического вращения
Физическая химия различных состояний нуклеиновых кислот (изотропного, кристаллического и жидкокристаллического) достаточно хорошо изучена. Конструируя биосенсоры на основе жидких кристаллов двухцепочечной ДНК [9], необходимо учитывать свойства, присущие только этим молекулам. В частности, известно, что в случае коротких "жестких" молекул ДНК легко предсказать и заранее программировать характер межмолекулярного взаимодействия в разных условиях, благодаря чему можно регулировать параметры создаваемых жидких кристаллов. В них азотистые основания сохраняют способность не только к взаимодействию с разными химическими и биологически активными веществами, но и к специфической ориентации относительно длинной оси молекулы нуклеиновой кислоты, что придает жидким кристаллам новую химическую реакционную способность.
Из названных свойств ДНК вытекают следствия, определяющие создание биосенсоров.
Во-первых, при формировании холестерических жидких кристаллов из молекул ДНК в спектре кругового дихроизма в полосе поглощения азотистых оснований появляется интенсивная линия.
Во-вторых, после обработки жидких кристаллов окрашенными биологически активными соединениями в этом спектре наблюдаются две линии. Одна из них расположена в области поглощения азотистых оснований и при неизменной вторичной структуре ДНК является "внутренним стандартом", отражающим качество сформированного жидкого кристалла, тогда как другая расположена в области поглощения биологически активного соединения, причем амплитуда этой линии пропорциональна концентрации биологически активного соединения, образующего комплекс с парами оснований ДНК.
В-третьих, биологически активные соединения, реагируя с парами оснований и располагаясь по-разному относительно длинной оси спиральной молекулы ДНК, генерируют оптические сигналы в разных областях спектра кругового дихроизма.
Наконец, оптический сигнал (в отличие от электрического), генерируемый при взаимодействии биологически активного вещества с жидкокристаллическим биосенсором, можно без каких-либо помех передать приемнику.
Эти следствия были "реализованы" в биосенсоре для определения концентрации биологически активных соединений в крови (патент России № 2107280 от 20 марта 1998 г.).
Следует отметить, что в рассмотренном типе биодатчиков чувствительными элементами являются азотистые основания ДНК. Однако в последнее время начата разработка принципиально нового типа биодатчиков на основе ДНК, чувствительный элемент которых вводится в состав полимерной цепочки, "сшивающей" соседние молекулы ДНК, специфическим образом расположенные в пространстве. Этот прием, получивший название "молекулярного конструирования", позволяет создавать полифункциональные жидкокристаллические датчики, содержащие чувствительные элементы разной химической природы. Такие биодатчики способны определять группы соединений, нарушающие свойства не молекул ДНК, а "чувствительных" элементов, находящихся между молекулами ДНК [9-11].
Одно из достижений биотехнологии и биоинженерии связано с развитием методов иммобилизации живых клеток в полимеры и твердые носители различной природы. Во многих биосенсорах нашли применение живые иммобилизованные клетки. Отметим их привлекательные свойства.
Клетки - доступный биологический материал. В биосенсорах используют клетки растений, животных, человека, но чаще клетки микроорганизмов, которые культивируются, легко воспроизводятся и поддерживаются в чистой культуре. В отличие от ферментов клетки не требуют дорогостоящих стадий очистки.
Методы иммобилизации позволяют получить клетки, сохраняющие около 100% активности ферментов и способные функционировать достаточно длительное время. Клетки сохраняют все наиболее важные структуры и проявляют большую стабильность. В некоторых случаях они обеспечивают жизнеспособность и активность ферментных систем в течение нескольких лет. Это позволяет проводить сложные последовательные реакции, осуществляя многостадийные процессы.
Для многих типов клеток, особенно микробных, предложены эффективные методы генетических операций, дающие возможность получать мутанты с высоким содержанием того или иного белка либо фермента, что открывает возможность для работы с высокоэффективными каталитическими системами. Поскольку клетки сохраняют аппарат биосинтеза белка, потенциально могут быть разработаны высокоэффективные методы гено-диагностики.
Особенности метаболизма клеток позволяют создавать биосенсоры для определения индивидуальных молекул и полифункциональные биосенсоры для обнаружения широкого класса соединений, например всей совокупности биологически поглощаемых веществ. В клеточных биосенсорах, как и в ферментных, используются самые разные физические преобразователи: электрохимические, включая амперометрические (детекторы кислорода пероксида водорода, медиаторы), потенциометрические (рН-чувствительные и ионселективные электроды, рН-чувствительные полевые транзисторы), кондуктометрические, оптические, акустические, калориметрические. Развитие получили биосенсоры со светоадресуемыми потенциометрическими сенсорами (LAPS). Они имеют достаточную чувствительность, и на их основе построены системы слежения за физиологическим состоянием отдельных клеток, так называемые микрофизиометры.
Сфера применения клеточных биосенсоров достаточно обширна. Созданы биосенсоры для селективного измерения содержания фенолов, пролина, глутамина, тирозина, молочной и аскорбиновой кислот, глюкозы. Интересные возможности связаны с анализом сульфат-иона, аммония, монометилсульфата. Уникальные возможности обеспечивают клеточные биосенсоры для экспресс-анализа качества воды и сточных вод.
Существует метод определения биологического потребления кислорода - анализ совокупности органических соединений, которые могут быть использованы микроорганизмами. Традиционная сенсорная система требует для получения данных нескольких дней, биосенсор с иммобилизованными клетками - всего нескольких минут. Коммерческие прототипы биосенсоров для оценки качества воды разработаны компаниями Японии, Германии и Бельгии.
Можно ожидать существенного вклада этих биоэлектронных устройств в повышение качества медицинских анализов, контроля технологических процессов, оценки пищевых продуктов и окружающей среды.
В ЧЕМ СХОЖИ И ЧЕМ РАЗЛИЧАЮТСЯ СЕНСОРНЫЕ СИСТЕМЫ И БИОСЕНСОРЫ?
Между сенсорными системами и биосенсорами много общего. Прежде всего они основаны на преобразовании внешнего воздействия в электрический сигнал. По-видимому, информацию, преобразованную в форму электрического ответа, можно эффективно трансформировать и перерабатывать. Органы чувств и биосенсоры имеют соответствующие системы переработки информации: в одном случае это мозг, в другом - компьютер. В биосенсорах, как и в сенсорных системах, используют различные механизмы усиления, позволяющие детектировать относительно слабые воздействия.
Вместе с тем очевидны и существенные различия. Сенсорные системы, прошедшие глубокую эволюцию, обладают более высокой чувствительностью, которая находится на грани возможностей, определяемых физическими законами. Она обеспечивается эффективными механизмами усиления и высоким отношением сигнала к шуму. Сенсорные системы способны перестраивать свою чувствительность (адаптироваться), измерять сигнал в широком диапазоне значений. Они также характеризуются высоким уровнем регенерации, поскольку их биохимические механизмы ресинтеза вышедших из строя элементов действуют очень эффективно.
Если рассматривать только чувствительность биологических и искусственных систем, то в настоящее время она выше у первых. Однако современные биосенсоры позволяют определять уже 10-21 М анализируемого вещества в растворе, то есть всего 1000 молекул в одном литре. Кроме того, созданы аналитические устройства, например, такие, как атомные силовые микроскопы, которые, будучи "крупногабаритными", все же позволяют проследить за изменением пространственной организации единичных молекул биополимеров (белков, нуклеиновых кислот и т.д.). Хорошо известны технические решения для систем, регистрирующих единичные фотоны. Важное обстоятельство - это размер искусственных аналитических устройств. Как только уровень, техники позволит их миниатюризировать, говорить о различиях в чувствительности сенсорных систем и биосенсоров, по-видимому, не придется. Но различия в адаптационной способности биологических сенсорных систем и биосенсоров остаются.
В сенсорных системах молекула биополимера -"датчика" (молекула рецептора фермента, белка, нуклеиновой кислоты и т.д.) - находится в конденсированном состоянии, свойства которого могут существенно отличаться от свойств изолированной молекулы этого биополимера. Параметры конденсированных состояний биополимеров еще только начинают исследоваться, и можно ожидать получения важной информации. В частности, уже известно, что в случае конденсированного (жидкокристаллического) состояния ДНК гидролитические ферменты "работают" очень быстро, причем сами ферменты начинают проявлять новую специфичность.
"Датчики" в сенсорных системах встроены (интегрированы) в структуру мембран, представляющих собой сложные образования из молекул липидов и белков. Поскольку пространственная организация мембран изучена недостаточно, остаются неясными связи между поведением мембран и "датчика", между возможным структурным соответствием состояния мембраны и "датчика", и наоборот. "Датчик" может выполнять также функцию "преобразователя" сигнала.
В органах чувств используется многоуровневая система биологического усиления сигнала, генерируемого молекулой - "датчиком" сигнала. Механизмы такого усиления и особенно его регуляции остаются в значительной мере неизвестными. Наконец, в сенсорных системах существует не только обратная связь типа "датчик" - мозг, но и механизм автоматической регенерации вышедших из строя дефективных или отработанных элементов.
Для дальнейшего использования принципов работы сенсорных систем при создании новых поколений биодатчиков, на наш взгляд, нужны исследования:
• свойств поверхностей синтетических и природных пленок, мембран и т.д., содержащих интегрированные в их структуры молекулы биополимеров - "датчики";
• конденсированного состояния молекул биополимеров (белков, нуклеиновых кислот и т.д.) в качестве "датчиков" и принципов работы биологически активных соединений в таких системах;
• механизмов усиления единичных сигналов, генерируемых биологически активными соединениями при их взаимодействии с потенциальными "датчиками";
• возможности миниатюризации известных аналитических устройств и их сочетания с уже известными биодатчиками.
Биосенсоры и биосенсорные технологии имеют одно неоспоримое преимущество. Они чрезвычайно многообразны и бесконечно изменчивы. Уже сегодня сенсорные технологии обеспечивают определение и анализ сигналов, далеко выходящих за рамки возможности органов чувств человека.
ПЕРСПЕКТИВЫ СОЗДАНИЯ НОВЫХ ОРГАНОВ ЧУВСТВ ЧЕЛОВЕКА
Потенциально достижимыми представляются несколько комбинаций сенсорных технологий и биологических сенсорных систем, дающих качественно новые решения, которые можно рассматривать как создание новых органов чувств человека.
Механо- и терморецепторы при визуализации изображений в различных электромагнитных полях. Если удастся преобразовать электромагнитное поле в электрический сигнал, вызывающий возбуждение рецепторной нервной клетки, то откроется возможность для регистрации изображения нервной системой путем возбуждения механо-и терморецепторов кожи. Можно ожидать появления кожных детекторов видимого и ультрафиолетового света, а также ионизирующего излучения. Тогда проблема визуализации, или получения изображения в электромагнитных полях, трансформируется в проблему обучения и распознавания образов центральной нервной системой. Не исключено создание кожных детекторов инфракрасного, радио-, рентгеновского и СВЧ-излучения.
Однако на этом пути многое остается неизвестным. Каковы необходимые плотности сигналов и возможная разрешающая способность распознавания образов такими системами? Можно ли увеличить качество изображения и чувствительность к электромагнитному полю, улучшая экспрессию механо- и терморецепторов кожи? Каковы границы качества изображения и роль обучения в эффективности работы системы распознавания образов?
Создание искусственного зрения на основе естественных рецепторов кожи поможет слабовидящим людям и слепым, позволит в экспресс-режиме предупреждать человека об опасности лучевого поражения.
"Химическое зрение". Биосенсоры успешно определяют содержание конкретных химических соединений или групп соединений, важных для медицинской диагностики, контроля качества пищевых продуктов и качества окружающей среды. Сопряжение биосенсоров с рецепторами позволит вывести эти системы анализа на уровень индивидуума, который будет способен детектировать внешние химические сигналы и проводить мониторинг внутреннего метаболического состояния. Новые рецепторные технологии должны расширить возможности хеморецепции, придать ей необходимую селективность и чувствительность. Например, чрезвычайно важно создать детекторы, непосредственно информирующие человека через его центральную нервную систему об опасных химических агентах: метане, угарном газе, фосфорорганических пестицидах и ядах.
Совершенно новые возможности связаны с "химическим зрением" метаболизма человека. Существующая интерорецепторная сигнальная система информирует его о дисбалансах и нарушениях посредством болевых ощущений. Однако сигнал поступает, как правило, после значительных и необратимых изменений. Сопряжение биосенсоров с рецепторами позволит человеку непрерывно следить за содержанием ряда ключевых метаболитов, используя в качестве регистрирующего органа центральную нервную систему. Системы непрерывного мониторинга лекарственные средств, глюкозы, мочевины, холестерина, молочной и мочевой кислот, этанола и ацетальдегида, окиси азота и других ключевых метаболитов могут качественно изменить природу медицинской диагностики и вывести ее на уровень индивидуального постоянного контроля.
Сопряжение сенсорных технологий и сенсорных систем - не фантастический мир неопределенного будущего, это реалии ближайшего десятилетия.
ЛИТЕРАТУРА
1. Сенсорные системы. 1997. № 4; 1998. № 1.
2. Островский M.A., Говардовский В.И. Механизмы фоторецепции позвоночных // Физиология зрения / Ред. А.Л. Бызов. М.: Наука, 1992. С. 5-58.
3. Roberts W.M., Howard J., Hudspeth A.J. Hair cells: transduction, tuning and transmission in the inner ear // Annu. Rev. Cell. Biol. 1988. V. 4. P. 63-92.
4. Березин И.В., Варфоломеев С.Д., Мартинек К. Цис-транс-фотоизомеризация a-химотрипсина и моделирования механизмов зрительной рецепции // Доклады АН СССР. 1970. Т. 193. С. 932-935.
5. Варфоломеев С.Д. Биосенсоры // Соросовский образовательный журнал. 1997. № 1. С. 47-50.
6. Dark L.C., Lyons C. Enzyme electrodes // Ann. N.Y. Acad. Sci. 1962. V. 102. P. 295.
7. Березин И.В., Богдановская В.А., Варфоломеев С.Д. и др. Биоэлектрокатализ. Равновесный кислородный потенциал под действием лакказы // Доклады АН СССР. 1978. Т. 240. С. 615-619.
8. Varfolomeev S.D., Kurochkin I.N., Yaropolov A.I. Direct electron transfer BIOSensors // BIOSensors Bioelectronics. 1996. V. II. №9. P. 863-871.
9. Yevdokimov Yu.M., Salyanov V.I., Semenov S.V. Analytical capacity of the DNA liquid-crystalline dispersions as BIOSensing unit // BIOSensors Bioelectronics. 1996. V. 11. №9. P. 889-902.
10. Евдокимов Ю.М. Биосенсоры на основе одно- и двухцепочечных нуклеиновых кислот // Сенсорные системы. 1998. Т. 12. Вып. 1. С. 5-21.
11. Yevdokimov Yu.M., Salyanov V.I., Lortkipanidze G.B. et al. Sensing biological effectors through the respons of bridged nucleic acids and polynucleotides fixed in liquid-crystalline dispersions // BIOSensors Bioelectronics. 1998. V. 13. № 3, 4. P. 279-291.
http://www.1543.su/VIVOVOCO/VV/JOURNAL/VRAN/BIOS.HTM
















Комментарии (0)