
«Средняя продолжительность жизни будет в районе 5 000 лет … к 2100 году».
Обри ди Грей (с)
Биологические системы замечательны своим искусным устройством. В XV веке Леонардо да Винчи писал: «Человеческая искусность способна многое изобрести, но все же она никогда не создаст предмет более прекрасный, простой и правильный, чем создает природа; потому что в ее изобретениях нет ничего лишнего, ничего недостающего». Мы разделяем благоговение да Винчи перед биологическими конструкциями, но мы не согласны с ним насчет нашей неспособности улучшить свою природу. Да Винчи не было известно о нанотехнологиях, и оказалось, что природа, при всей своей внешней изобретательности, чрезвычайно неоптимальна. Например нервные связи в нашем мозге вычисляют только по 200 операций в секунду, что в миллионы раз медленней, чем современные электросхемы.
Несмотря на всю искусность, с которой наши эритроциты переносят кислород у нас в кровотоке и доставляют его в наши ткани, это все еще медленная и неповоротливая система, и замена в виде роботов (респироцитов) уже существует на чертежной доске и будет в тысячи раз эффективнее эритроцитов. Реальность такова, что биология никогда не сможет создать то же самое, что сможем спроектировать мы, как только полностью поймем принципы функционирования биологии.
Еще один важный компонент грядущей революции — молекулярная нанотехнология, которая в конечном итоге позволит нам перепроектировать и перестроить, молекула за молекулой, наши тела и мозг. Время двух этих революций — в биотехнологиях и нанотехнологиях — параллельно, но биотехнологическая революция приведет к полной реализации нанотехнологической через одно-два десятилетия. Поэтому мы называем их Вторым и Третьим мостом (Bridge Two и Bridge Three) по отношению к радикальному продлению жизни. «Первый мост» (Bridge One) – способ извлечь максимальную пользу из самых современных методов диагностики и профилактики, существующих на сегодняшний день, чтобы перейти ко Второму и Третьему мосту.
ОТ МОСТА К МОСТУ К МОСТУ
1. Первый мост — «Программа долголетия», о которой речь шла в предыдущей статье — состоит из методов лечения сегодняшнего дня и руководств, которые дадут вам возможность сохранить здоровье настолько долго, чтобы максимально воспользоваться возведенным Вторым мостом.
2. Второй мост — биотехнологическая революция. Когда мы изучим свой генетический и белковый код, мы сможем обращать вспять болезни и процесс старения, при этом включим на полную мощность свой человеческий потенциал. Второй мост, в свою очередь, приведет к Третьему мосту.
3. Третий мост — нанотехнологии, революция ИИ (искусственный интеллект). Эта революция даст нам возможность перестраивать свои тела и мозг на молекулярном уровне.
Такие грядущие новшества в технологиях возвестят о появлении новых мощных средств укрепить здоровье и расширить человеческие возможности. Представленные знания будут приниматься автоматически. Сегодня, тем не менее, вам необходимо применять эти знания самим. Мы расскажем вам о каждом из этих трех мостов, когда они будут относиться к обсуждаемой теме. Мы начнем со стратегий Первого моста (Bridge One), которые вы можете применять уже сегодня. Когда уместно, мы будем включать заманчивый прогноз того, что в ближайшем будущем смогут предложить Второй и Третий мост.
ВТОРОЙ МОСТ (BRIDGE TWO):
БИОТЕХНОЛОГИЧЕСКАЯ РЕВОЛЮЦИЯ
Поскольку мы узнаём, как преобразуется информация в биологических процессах, появляется много способов преодолеть болезни и процесс старения. Мы рассмотрим самые многообещающие подходы. Важно начать с основы биологической информации: генома. С помощью генетических технологий сейчас мы близко подошли к тому, чтобы управлять экспрессией генов. В конечном итоге мы сможем изменять сами гены.
Уже сегодня мы применяем генетические технологии у других видов. Используя метод под названием технология рекомбинации, который используется коммерчески, чтобы сделать много новых фармацевтических препаратов, гены организмов — от бактерий до фермерских животных — модифицируются, чтобы произвести белки, необходимые нам для борьбы с людскими болезнями.
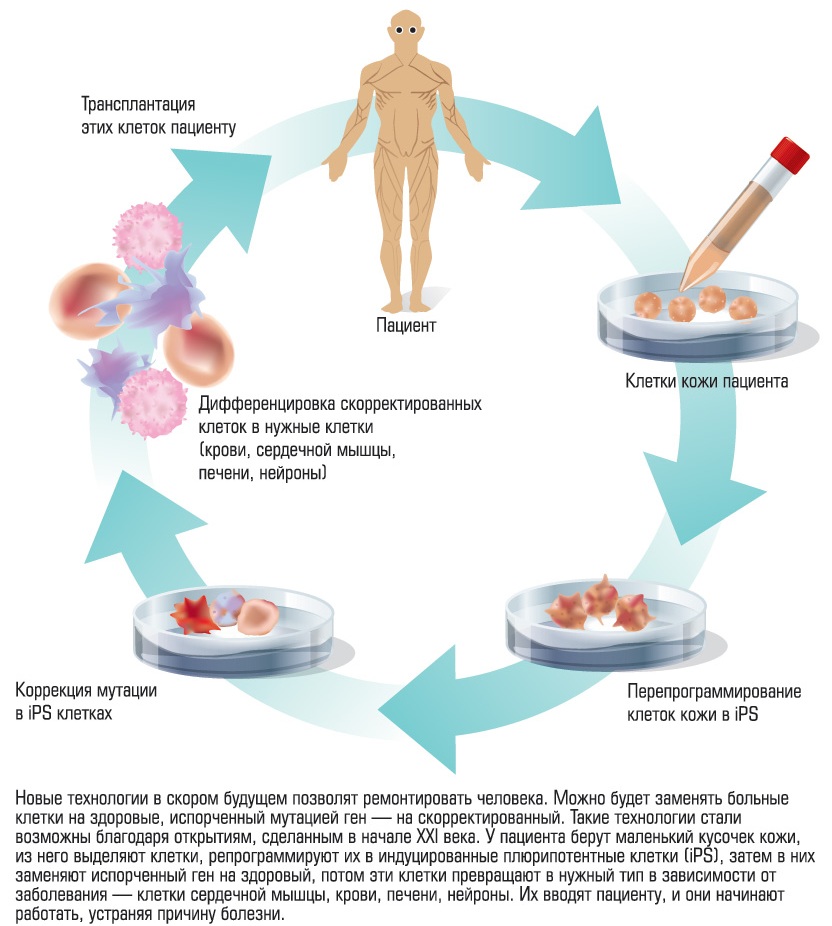
Еще одна важная линия — выращивать свои клетки, ткани и даже целые органы и вводить их в свой организм без хирургического вмешательства. Главное преимущество этой терапевтической техники клонирования состоит в том, что мы сможем создать эти новые ткани и органы из своих собственных клеток, которые также сделаем моложе — новая область медицины омоложения.
Когда мы поймем информационные процессы, лежащие в основе биологии, мы найдем способы управлять ими, чтобы победить болезни и процесс старения, а также расширить человеческий потенциал. Изобретение лекарств когда-то было способом найти вещество, которое дает благотворный эффект без чрезмерных побочных эффектов. Этот процесс был подобен изобретению инструментов древними людьми, которое состояло в том, чтобы просто найти камни и принадлежности естественного происхождения, которые можно было использовать для своей пользы. Сейчас, когда мы можем создавать лекарства для решения конкретных задач на молекулярном уровне, мы в состоянии преодолеть связанные со старением недуги. Объем и масштаб этих действий широк; приведенные примеры — всего лишь небольшой образец самых многообещающих тенденций.
НЕ ПРОСТО ПРОЕКТИРОВЩИКИ ДЕТЕЙ,
А ПРОЕКТИРОВЩИКИ ИЗ ПОКОЛЕНИЯ БЕБИ-БУМА
Генетические технологии будут включать три этапа:
1. Влияние на метаболическую регуляцию экспрессии генов
2. Подавление или изменение экспрессии генов
3. Соматическая генная терапия
Давайте обсудим, как эти грядущие технологии могут повлиять на ваш личный путь в будущее.
Влияние на метаболическую регуляцию экспрессии генов
Наука пока не знает способов изменить ваши гены (хотя это и начинает работать), но, зная, какие у вас гены, вы можете выбирать соответствующий образ жизни и заранее принять меры, чтобы изменить их влияние. Как мы расскажем в главе Перспективы геномики, у вас уже есть средства, чтобы прочитать часть своего генетического строения и использовать эту информацию, чтобы выбрать свой образ жизни, правильное питание и нужные добавки. Вы можете использовать эту информацию, чтобы составить свою собственную индивидуальную программу, как избежать болезней и прогрессирующих дегенеративных состояний, к которым вы генетически предрасположены.
Подавление или изменение экспрессии генов
Хотя у нас нет возможности изменять сами гены, мы скоро сможем менять их экспрессию. Генетическая экспрессия — процесс, в котором считывается ваша генетическая программа и выполняются ее указания. Каждая клетка вашего организма имеет полный набор всех ваших генов. Но некоторые клетки, например клетки кожи или инсулоциты поджелудочной железы, получают характеристики только от небольшой части всего генетического материала, который несут, — генетической информации, относящейся к этому особому виду клетки. Поскольку возможно управлять этим процессом вне клеточного ядра, проще выполнить эти методы подавления генов, чем методы лечения, которые требуют доступа внутрь ядра.
Экспрессию генов контролируют пептиды, молекулы, состоящие из последовательностей аминокислот и коротких нитей РНК. Ученые только начинают узнавать, как работает этот процесс. Много новых методов лечения сейчас на стадии разработки и тестирования, они основаны на манипулировании этой генетической экспрессией, чтобы либо выключить гены, которые вызывают болезни, либо включить желательные гены, которые иначе могут быть неэкспрессированы в определенном виде клеток.
Развиваются два новых метода лечения путем подавления и изменения экспрессии генов — это антисмысловая терапия и РНК-интерференция. Цель этих методов лечения — матричная РНК (мРНК), которая транскрибируется (копируется) из ДНК и затем транслируется в белки. Для поврежденных или мутировавших генов исследователи изучают способы подавить мРНК, созданную этими генами, чтобы они не могли производить нежелательные белки. В процессе репарации используется зеркальное отображение последовательностей РНК, под названием антисмысловая РНК. Последовательности связываются с аномальной, кодирующей белки РНК, предотвращая ее экспрессию.

При работе с РНК (РНК-интерференцией) исследователи строят короткие двойные нити сегментов РНК, которые содержат и «смысловые», и «антисмысловые» нити. Они соответствуют и герметично связываются с участками РНК, транскрипция которых сделана из мутировавших генов. Это подавляет естественную возможность участков РНК создавать белки, эффективно заглушая дефектный ген. Недавно при испытаниях такое использование обеих нитей РНК оказалось значительно эффективней, чем просто использование антисмысловой нити. При многих генетических болезнях дефектна только одна копия какого-то гена. Поскольку вы берете две копии каждого гена, по одной от каждого родителя, такой подход позволяет одному здоровому гену создать необходимый белок.
Соматическая генная терапия
Это святой Грааль биоинженерии. На этом третьем этапе гены внутри ядра эффективно меняются с помощью «заражения» ядра новой ДНК, по сути, с помощью создания новых генов. Концепция изменения генетического строения человека часто связана с идеей о «проектировании детей». Но что действительно обещает генная терапия, так это менять гены у нас, взрослых. Такие новые гены могут быть созданы либо чтобы подавить нежелательные, вызывающие болезнь гены, либо чтобы ввести новые гены, которые замедляют или обращают вспять процессы старения.
Исследования на животных начались в 70-е и 80-е годы, и сейчас успешно создан целый ряд «трансгенных» животных, включая крупный рогатый скот, кур, кроликов и морских ежей. В 1990 году состоялась первая попытка генной терапии у человека. Остается задача передать терапевтическую ДНК в нужные клетки, чтобы затем обеспечить экспрессию ДНК в нужных объемах и в нужное время.
Давайте сначала посмотрим, как происходит перенос нового генетического материала. Вирус часто является желательным переносчиком. Давным-давно у вирусов появилась способность передавать свой генетический материал в клетки человека, что часто заканчивается болезнью. Сейчас исследователи просто убирают вредные гены вируса, а вместо них вводят лечебные гены, так что вирус затем «заражает» клетки человека этими полезными генами. Это довольно незатейливый способ, но гены вируса часто слишком велики, чтобы пройти во многие виды клеток, например клетки мозга. Другое ограничение этого процесса — длина ДНК, которую можно передать. Также трудно контролировать точное место, где новая вирусная ДНК вводится в последовательность ДНК нужной клетки. Кроме того, такое «инфицирование» может вызвать иммунную реакцию, что заканчивается отторжением нового генетического материала.
Смерть двоих участников в исследованиях генной терапии несколько лет назад вызвала временную задержку, однако с тех пор исследование возобновилось. Один пациент умер от иммунной реакции на вирусный вектор. Второй пациент, который страдал тяжелым комбинированным иммунодефицитом (синдромом мальчика в пузыре), — по сути, он родился без иммунной системы — заболел лейкемией, которая возникла из-за несоответствующего размещения передаваемого гена в клетках. Эта вторая смерть указывает на два главных препятствия, с которыми приходится столкнуться, чтобы генетическая терапия была успешной: как правильно поместить новый генетический материал в нити ДНК пациентов и как отслеживать экспрессию гена. Одно из возможных решений — ввести отображающий ген-«докладчик» наряду с лечебным геном. Ген-докладчик дает сигналы изображения, которые позволяют тщательно отслеживать генную терапию. Процесс возможно продолжить, только если размещение нового гена проверено и правильно.
Генная терапия начинает работать
Коллектив под руководством доктора Эндрю Бейкера, исследователя из университета Глазго, успешно использовал аденовирусы, чтобы не затрагивать печень и «заразить» определенные органы или участки в органах. К примеру, исследователи смогли направить генную терапию на выстилающие кровеносные сосуды эндотелиальные клетки. Бейкер говорит, что его работа может «улучшить избирательность, эффективность и безопасность переноса гена в сердечно-сосудистую систему».
Другой подход впервые попробовал коллектив под руководством Крейга Вентера, главы частной компании, который успешно расшифровал геном человека, который уже продемонстрировал способность создать искусственные вирусы из генетической информации. Главное применение — конструирование вирусов, чтобы передать новую генетическую информацию для генной терапии.
Механическая инъекция (микроинъекция) ДНК в клетки возможна, но непозволительно дорога. Знаменательные успехи были недавно достигнуты с помощью других средств передачи. Например жировые сферы с жидкой сердцевиной, под названием липосомы, можно использовать как молекулярного троянского коня, чтобы передать гены в клетки мозга. Это открывает перспективы для лечения таких болезней, как болезнь Паркинсона и эпилепсия. Можно также использовать электрические импульсы, чтобы передавать ряд молекул, включая лекарственные белки, РНК и ДНК, в клетки.
Еще одна возможность — упаковать ДНК в мельчайшие (25-нанометровые) наношары для максимального влияния. Этот метод уже проверяют на людях, страдающих муковисцидозом. Исследователи сообщили о «6000-кратном увеличении экспрессии упакованного таким образом гена, по сравнению с неупакованной ДНК в липосомах».
Но еще один метод — использовать ДНК в сочетании с микроскопическими пузырями. Используются ультразвуковые волны, чтобы сжать пузыри, обеспечивая возможность пройти через клеточную оболочку.
РЕКОМБИНАНТНАЯ ТЕХНОЛОГИЯ: СТАВКА НА РОДСТВЕННОЕ ВЖИВЛЕНИЕ
Мы уже используем генную терапию у других видов. Изменяя гены бактерий, растений и животных, мы можем заставить их производить вещества, которые необходимы нам для борьбы с болезнями человека. Рекомбинированные белки, созданные с помощью комбинации ДНК нескольких организмов, сейчас производятся бактериями, это новая генная модификация, которая соответствующе называется фарминг. В технологии рекомбинации генетический материал, который кодирует желаемый белок, сплайсируется в ДНК некоторых видов бактерий, которые потом начинают работать, производя этот белок. Учитывая, с какой скоростью размножаются бактерии, нетрудно таким образом создать большой объем белков. Инсулин был первой искусственно созданной молекулой с помощью технологии рекомбинации, поэтому инсулинозависимые диабетики больше не привязаны к инъекциям инсулином быка или свиньи. У многих больных диабетом возникали аллергические реакции или высокий уровень антител как ответ на чужеродный белок, содержащийся в инсулине, приготовленном из быков и свиней. С рекомбинированным инсулином человека это больше не проблема.
Дети с дефицитом гормона роста (лилипуты) раньше пользовались инъекциями СТГ (соматотропина), гормона роста человека, полученного из гипофиза человеческих трупов. Требовалось много трупов, чтобы получить достаточно соматотропина всего для одного ребенка на год. Также был риск инфекций. Рекомбинированный СТГ решил эту проблему и значительно снизил стоимость лечения. Также он позволил получать лечение и взрослым с дефицитом гормона роста.
Гены из белков также были сплайсированы в иммортализованные клетки почки человека и теперь вживляются, чтобы создать белки, полезные для лечения пациентов, перенесших инсульт, а также многие другие болезни. Пациенты с хроническим заболеванием почек страдают дефицитом белка, который вырабатывают почки, под названием эритропоетин. Без эритропоетина развивается тяжелая анемия и требуются частые переливания крови. Вживляя гены, которые кодируют этот белок, в клетки хомяка, фармацевтические компании могут создавать эритропоетин в достаточном количестве, чтобы избежать частых переливаний у многих пациентов на диализе.
Также найдены новые методы с участием обычных сельскохозяйственных животных. Коровы дают много молока, поэтому сплайсирование ДНК в гены, кодирующие молоко, ценный метод. Кодирующая яичный протеин ДНК сейчас используется, чтобы яйца трансгенных (содержащих искусственно введенные ген или гены разных видов) кур содержали полезные белки. В ближайшем будущем у нас появятся животные с модифицированными генами, молоко, яйца или даже семя которых будут производить рекомбинантные белки, чтобы лечить в настоящее время неизлечимые или только отчасти излечимые заболевания, такие как рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера, гепатит С и СПИД.
Такие технологии не ограничивается только животными. Растения, особенно с большим содержанием белка, например кукуруза или табак, можно перепрограммировать, чтобы они производили ценные вещества. В Японии, например, сорт генетически модифицированного риса содержит белок, способный убивать вирус гепатита B.
ТЕРАПЕВТИЧЕСКОЕ КЛОНИРОВАНИЕ
Один из самых мощных методов применения механизма самой жизни, чтобы улучшить и продлить жизнь, включает репродуктивные механизмы «монтажной биологии» в виде клонирования. Клонирование — чрезвычайно важная технология не для создания полноценных людей, но для продления жизни. Терапевтическое клонирование создает новые ткани, чтобы заменить поврежденные ткани или дефектные органы.
Все ответственные этики, включая авторов, в настоящее время считают клонирование человека неэтичным, хотя наши причины имеют мало общего с сомнительными проблемами манипулирования человеческой жизнью. Скорее, технология сегодняшнего дня просто не слишком надежна. Современный метод подразумевает слияние донорского клеточного ядра с яйцеклеткой реципиента при помощи электрической искры и вызывает высокий уровень генетических ошибок.
Первейшая причина в том, что большинство созданных таким образом эмбрионов пока что родились не в срок. Даже у тех, которые выжили, есть генетические дефекты. У овечки Долли во взрослом возрасте появилась проблема ожирения, и у большинства клонированных животных возникают непредсказуемые проблемы со здоровьем. У ученых есть ряд идей, как усовершенствовать этот процесс, включая альтернативные способы слияния клеточного ядра и яйцеклетки без использования разрушительной электрической искры. Как бы то ни было, до тех пор пока технология не станет очевидно безопасной, было бы неэтично создавать человеческую жизнь с такой большой вероятностью серьезных проблем со здоровьем.

Тем не менее, самое ценное применение технологии клонирования не в том, чтобы создавать полноценные человеческие существа, а в том, чтобы создавать человеческие органы, например сердца и почки. Это делается с использованием клеток зародышевой линии — клеток предэмбриональной стадии (до имплантации эмбриона). Эти клетки зародышевой линии проходят дифференциацию, после этого могут развиться в соответствующие органы. Поскольку дифференциация происходит на предэмбриональной стадии, большинство этиков считает, что этот процесс не вызывает этических проблем, хотя это очень дискуссионный вопрос.
Коллектив исследователей под руководством Хван У Сока и Шин Янг Муна в Сеульском национальном университете Южной Кореи сделал важный шаг к усовершенствованию этой технологии. В опубликованной в журнале Science статье они объявили, что успешно клонировали линию плюрипотентных стволовых клеток человека, клетки такого типа потенциально могут обратиться в любой вид клеток организма. Их линия клеток уже без происшествий прошла 70 репродукций. Это исследование открывает путь серьезным достижениям в производстве из линии клонированных стволовых клеток здоровых человеческих тканей и органов для замены.
Победить запрограммированную гибель клеток
Терапевтическое клонирование относится к теломерам, которые представляют собой цепи повторяющегося кода на конце каждой нити ДНК. Такие повторяющиеся коды похожи на цепь бусин, в которой каждая «бусина» отделяется каждый раз, когда делится клетка. Это накладывает ограничение на количество раз, которое клетка может реплицироваться, — так называемый предел Хейфлика. Как только бусины ДНК выбывают, клетка запрограммирована погибнуть. Недавно было открыто, что фермент под названием теломераза, может удлинить звенья теломера, тем самым преодолеть лимит Хейфлика. Клетки зародышевой линии создают теломеразу и бессмертны. Раковые клетки также производят теломеразу, что позволяет им бесконечно делиться. Идентификация этого фермента дает возможность управлять этим процессом, и либо продлить жизнь здоровых клеток, либо прекратить существование патологических клеток, например раковых.
Интересно отметить замечательную устойчивость клеток зародышевой линии, которые связывают всю клеточную жизнь на Земле. Клетки зародышевой линии избегают разрушения с помощью фермента теломеразы, который заново воспроизводит цепочку теломер после каждого деления клетки. Этот фермент делает клетки зародышевой линии бессмертными, и, конечно, эти клетки выжили с начала жизни на Земле миллиарды лет назад. Это открытие дает возможность генной терапии в будущем, которая будет возвращать клетки в молодое, продленное теломеразой состояние. Эксперименты на животных показали, что теломераза относительно безвредна, хотя некоторые эксперименты закончились повышенным уровнем рака.
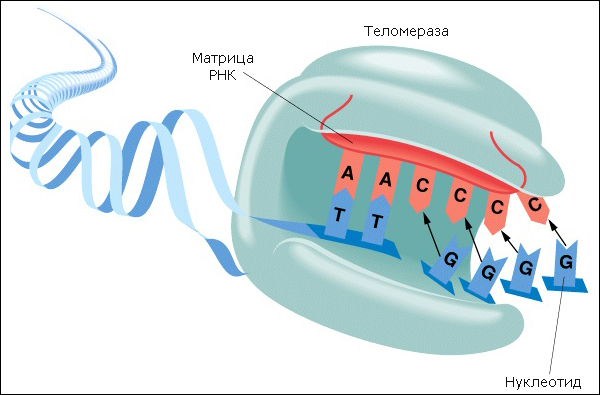
Также существует задача передать теломеразу в ядро клетки, но необходимая технология генной терапии сейчас значительно улучшается. Такие ученые, как Майкл Уэст, президент и директор компании Advanced Cell Technology (Современные клеточные технологии), выразил уверенность, что новые технологии позволят передавать теломеразу в клеточное ядро и преодолеть проблему рака. Генная терапия с помощью теломеразы обещает бесконечно омолаживать соматические клетки (не клетки зародышевой линии) — то есть все клетки человека.
Быстро идет прогресс в выращивании новых тканей и органов из стволовых клеток. Команда Роберта Лангера в Массачусетском технологическом институте вырастила примитивные версии человеческих органов, таких как печень, хрящи и нервные ткани. Их метод — выращивать клетки на специальном биоразлагаемом полимерном каркасе, который имеет губчатую структуру и приблизительную форму желаемого органа. Лангер и его команда пишут: «Здесь мы в первый раз показываем с помощью полимерного каркаса стимулируемую пролиферацию, дифференциацию и организацию человеческих эмбриональных стволовых клеток в трехмерные структуры».
Трудность при выращивании новых органов человека в том, как создать функционирующую систему кровеносных сосудов. Исследователи из Массачусетского технологического института и Гарвардской медицинской школы сконструировали работающую искусственную систему сосудов, используя два гравированных компьютером биоразлагаемых полимера, соединенных вместе слоями, чтобы создать капилляры шириной 10 микрон, а также артерии и вены до 300 раз шире.
Многообещающий метод, который не вызывает этических споров по поводу использования тканей плода, при этом также являющийся существенным источником стволовых клеток, число которых в настоящий момент ограничено, это партеногенез, или так называемое девственное размножение. Добавив некоторые химические вещества в неоплодотворенные яйцеклетки человека, можно превратить их в эмбрионы, которые затем могут служить как источник новых стволовых клеток. Эти эмбрионы, называемые партенотами, никогда не станут младенцами, поэтому не должно возникать никаких этических проблем при разрушении тканей, которые в любом случае обречены на разрушение. Еще одна интересная идея для женщины, это образовать партеноты из ее собственных яйцеклеток, чтобы создать стволовые клетки с ее собственной ДНК, избежав таким образом возможного отторжения чужеродных клеток иммунной системой пациентки.
Соматическая клеточная инженерия человека
Это даже еще более перспективный метод, который позволяет полностью избежать споров по поводу использования эмбриональных стволовых клеток. Такие новые технологии, также называемые «трансдифференциация», создания новых тканей с собственной ДНК пациента преобразованием клеток одного типа (например клеток кожи) непосредственно в клетки другого типа (например инсулоциты поджелудочной железы или клетки сердца) без использования эмбриональных стволовых клеток. В этой области недавно были сделаны прорывы. Ученые из Соединенных Штатов Америки и Норвегии успешно превратили клетки кожи человека непосредственно в клетки иммунной системы и нервные клетки. Компания по биотехнологиям Hematech перепрограммировала клетки фибробласты в первоначальное состояние, из которого они могут превратиться в клетки другого вида.
Рассмотрим вопрос: какая разница между клетками кожи и любыми другими клетками организма? Прежде всего, у них у всех одна и та же ДНК. Как указано выше, найдена разница в сигнальных факторах белка. Они включают короткие фрагменты РНК и пептиды, которые мы начинаем сейчас понимать. Манипулируя этими белками, мы можем превратить клетку одного вида в другую.
Совершенствование этой технологии не только снимет бесконечные этические и политические вопросы, оно также даст идеальное решение с научной точки зрения. Если вам нужны инсулоциты поджелудочной железы или ткани почки, — или даже целое новое сердце — чтобы избежать аутоиммунных реакций, вы, разумеется, предпочтете, чтобы они были сделаны с вашей собственной ДНК, а не с ДНК клеток зародышевой линии кого-то другого. И при этом методе используются ваши клетки кожи, которых у вас много, а не ваши редкие драгоценные стволовые клетки.
С помощью этого процесса напрямую можно вырастить орган с вашим генетическим строением, и теломеры нового органа могут быть продлены до свойственной им в молодости длины, что успешно вновь сделает орган молодым. Это значит, что 80-летний человек может снова получить вместо своего сердца сердце, которое у него было в 25.
Главный ген, который позволяет стволовым клеткам оставаться молодыми и плюрипотентными (способными дифференцироваться в клетку практически любого вида) был открыт и назван наног (Nanog) коллективом из Института исследований клеточных технологий Эдинбурга, Шотландия. «Кажется, что наног — главный ген, который заставляет эмбриональные стволовые клетки расти в лаборатории, — говорит Ян Чемберс, один из ученых коллектива. — Фактически он (ген) делает стволовые клетки бессмертными». Это серьезный шаг к тому, чтобы превратить любую клетку, например клетку кожи, в плюрипотентную клетку, которая затем может трансформироваться в любую другую клетку.
Стать моложе

Ученые из Европейской лаборатории по молекулярной биологии в университете Рима определили белок под названием mlGF-1, который заставляет стволовые клетки из других частей организма быстро мигрировать в мышцы, поврежденные в результате болезни или травмы. Способность организма производить mlGF-1 с возрастом уменьшается, но возрастные процессы можно обратить, управляя этим белком. Это может быть ключевым шагом в терапии стволовыми клетками.
Еще лучше выглядит перспектива заменить чьи-то органы и ткани его собственными «молодыми» вариантами без хирургического вмешательства. Клонированные с продленными теломерами клетки, введенные в орган, интегрируются с более старыми клетками. После нескольких сеансов лечения некоторый период времени в органе будут преимущественно молодые клетки. Обычно наши собственные клетки регулярно заменяются, так почему бы не сделать это с помощью молодых клеток с продленными теломерами, а не с помощью более старых с укороченными теломерами? Нет ни одной причины, почему бы мы не могли делать это практически с каждым органом и тканью нашего организма. Так мы будем постоянно становиться все моложе.

















Комментарии (0)